
某同学为了测定汉白玉中碳酸钙的质量分数,称取5.55 g研碎的汉白玉粉末,进行四次高温加热(杂质不参加反应)、冷却、称量剩余固体的重复操作。记录数据如
|
操作次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
剩余固体质量(g) |
4.25 |
3.95 |
3.35 |
3.35 |
请计算:
(1)完全反应后生成二氧化碳 g。
(2)求汉白玉中碳酸钙的质量分数。
(3)该同学为了其他研究需要,另取一定质量的汉白玉粉与镁粉混合,在空气中加热至反应完全(杂质不参加反应),测得反应前后质量不变,求汉白玉粉和镁粉的质量比。
(1)2.2(2)90.1%(3)5:3
【解析】试题分析:根据CaCO3高温煅烧易分解生成CaO和CO2分析,由于反应有气体生成并逸出,根据质量守恒定律“参加反应前各物质的质量总和等于反应后生成各物质的质量总和”可知,固体质量会减少,且减少的质量为生成的二氧化碳气体的质量。
(1)由图表可知,第三次和第四次剩余固体的质量相等,说明,第三次已经完全反应。由于生成的气体逸出,所以完全反应后生成的二氧化碳的质量=反应前汉白玉粉末的质量-剩余固体的质量= 5.55g-3.35g=2.2g。
(2)根据碳酸钙高温分解的化学方程式,得出各物质之间的质量比,列出比例式,即可求出参与反应的CaCO3的质量,然后根据质量分数公式计算即可。
解:设5.55 g研碎的汉白玉粉末中的CaCO3的质量为x,
CaCO3  CaO+CO2↑
CaO+CO2↑
100 44
x 2.2g
∴100:44 =x:2.2g
解之得:x=5g,
所以汉白玉中碳酸钙的质量分数为: × 100%≈90.1%
× 100%≈90.1%
答:汉白玉中碳酸钙的质量分数为90.1%
(3)根据CaCO3和Mg在空气中加热的化学方程式:CaCO3  CaO+CO2↑,2Mg+O2
CaO+CO2↑,2Mg+O2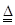 2MgO
2MgO
观察方程式并结合题意可知,CaCO3反应放出的CO2的质量等于Mg反应吸收的O2的质量。
故可设O2的质量=CO2的质量=X,设CaCO3的质量为m,Mg的质量为n,则有
CaCO3  CaO+CO2↑, 2Mg + O2
CaO+CO2↑, 2Mg + O2 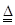 2MgO
2MgO
100 44 48 32
m x n x
100:44=m:x 48:32=n:x
解得 m=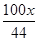 ,
n=
,
n=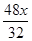
则混合物中的CaCO3的质量=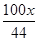 ,Mg的质量=
,Mg的质量=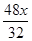 =1.5x,
=1.5x,
又因为汉白玉中含CaCO3的质量分数为90.1%,所以汉白玉粉为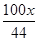 ÷90.1%≈2.5X,
÷90.1%≈2.5X,
所以汉白玉粉与镁粉的质量比为2.5x:1.5x=5:3
答:汉白玉粉和镁粉的质量比为5:3
考点:本题考查含杂质物质的化学反应的有关计算
点评:解此类题,要能理解和掌握质量守恒定律,并能在实际计算时灵活运用。同时要注意严格遵循有关计算的方法、步骤和格式等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
查看答案和解析>>
科目:初中化学 来源:盐城 题型:问答题
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
查看答案和解析>>
科目:初中化学 来源:《5.4 石灰石的利用》2010年同步练习(1)(解析版) 题型:解答题
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
查看答案和解析>>
科目:初中化学 来源:2003年江苏省盐城市中考化学试卷(解析版) 题型:解答题
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com