
【题目】下图中A、B、C、D为四种粒子的微粒结构示意图,E为钙元素在周期表中的信息。请按要求填空:
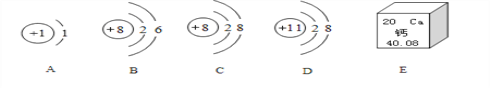
(1)在A、B、C、D中共表示____种元素的粒子;具有相对稳定结构的粒子是______;表示阳离子的是_________。
(2)A的单质在B的单质中燃烧的化学方程式是_________。
(3) E中钙原子的相对原子质量是____________。
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
[提出问题] 它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
[实验探究1] 向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下表:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠 溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液 显示的颜色 | 蓝色 | 绿色 | 黄色 |
[得出结论1] 三种溶液的碱性由强到弱的顺序为______________________。
[实验探究2] 甲同学在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由______色变为________色。向其中加入稀盐酸,该反应的化学方程式为___________。乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如下图甲所示。a点表示的含义是________________。
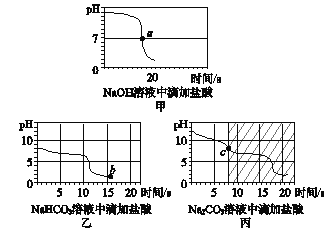
[得出结论2] 从微观角度分析,该反应的实质是_____________________。
[实验探究3] 向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图乙、图丙所示。
[交流与反思] b点的溶质为____________________。(填化学式),将图乙和图丙中的阴影部分进行叠加,发现两者基本重合,c点的溶质为____________(填化学式)。
[得出结论3] 通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:______、______________。
[结论与反思] 探究溶液的酸碱性及反应pH的变化,可以认识反应的原理及进行的过程。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某同学配制一定质量的0.9%的生理盐水的全过程。
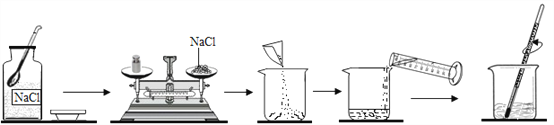
(1)请找出上图中的错误:①______________②______________ ③______________
(2)如果配制的生理盐水中NaCl的质量分数小于0.9%,则可能造成误差的原因有(至少举出三点):①_______________ ②______________ ③_________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)某种氧化铜样品中混有少量木炭粉,为测定该样品中氧化铜的质量分数,某同学设计了如下装置进行实验(N2不参加反应,不考虑外界空气对实验的影响)。
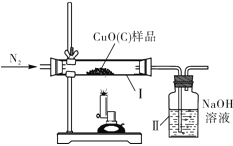
①该实验需要测定的量:反应前后装置Ⅱ的质量和 的质量
②充分反应后,装置Ⅱ的质量增加了0.44 g,求参加反应的氢氧化钠的质量。(请根据化学方程式列式计算)
③为达到实验目的,对反应前取用10%的氢氧化钠溶液要求是 g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)小明在实验室做实验的时候,获得了两种溶液:氢氧化钠溶液和石灰水。
①如果他想验证某瓶气体样品中是否含有二氧化碳,他应该选用的是_________溶液,理由是________________。
②若想除去气体样品中的二氧化碳,他应该选用的是________溶液,理由是_________。
(2)如图所示,挤压胶头滴管,使其中的液体与瓶中固体接触,可使小气球鼓起来。请写出符合下列要求的化学方程式:
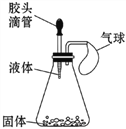
①分解反应___________________________________;
②化合反应___________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2013年1月4日,国家发改革委宣布对韩国三星等六家企业合谋操纵液晶面板价格实施处罚。MBBA是一种液晶材料,其化学式为C18 H21NO。下列有关说法中,正确的有
A.MBBA由三种元素组成 B.一个MBBA分子中共含有39个原子
C.MBBA中氢元素质量分数最大 D.MBBA中碳、氧元素质量比为27:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)为白色或淡黄色结晶粉末,是一种用途广泛的优良供氧剂,可用于鱼类养殖、农作物载培、污水处理等多方面。工业上可用大理石作原料制备过氧化钙,某校课外活动小组同学模拟工业过程制备过氧化钙样品并测量其纯度。
[查阅资料]①过氧化钙固体难溶于水,加热至315℃时开始分解,完全分解的温度为400~425℃。
②常温下过氧化钙干燥且很稳定。过氧化钙能溶于稀酸生成过氧化氢,过氧化钙在湿空气或水中会逐渐缓慢地分解,长时间放出氧气。
[实验一]提纯碳酸钙
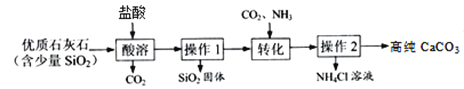
已知:“转化”步骤中的反应方程式为:CaCl2 + NH3 + CO2 + H2O = CaCO3↓ + 2NH4Cl
(1)酸溶过程中发生反应的化学方程式是___________________________________。
(2)过程中的生成物可直接应用于流程的是_______________。
[实验二]过氧化钙的制备:
已知:①CaCl2 + H2O2 + 2NH3·H2O + 6H2O=CaO2·8H2O + 2NH4Cl;
②CaO2·8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2。

(3)为控制沉淀的温度为0℃左右,在实验室宜采取的方法为_____________________。
(4)操作A在实验室常用的步骤有_____________、降温结晶、过滤、洗涤、干燥,此操作中洗涤晶体时不可选用的洗涤剂为____________(用序号填空)。
a.冰水 b.40℃热水 c.饱和NH4Cl溶液
(5)最后烘干得到过氧化钙时,适宜的温度范围为_____________。
(6)已知产品的产率=![]() ,则此制备流程中CaO2的产率为__________。(写出计算过程,结果保留一位小数,2分)。
,则此制备流程中CaO2的产率为__________。(写出计算过程,结果保留一位小数,2分)。
(7)实验室现有溶质质量分数为37%、密度是1.18g·mL-1的浓盐酸,则配制12%的稀盐酸100g,需要水____________mL(水的密度是1g·mL-1,计算结果保留一位小数)。
[实验三]过氧化钙含量的测定
该活动小组设计下列装置,通过测定生成O2的体积,计算样品中CaO2的质量分数。
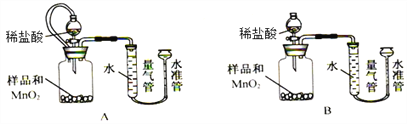
已知:a.CaO2 + 2HCl = CaCl2 + H2O2 b.杂质不与盐酸反应生成气体
(8)实验中MnO2的作用是____________________。
(9)相同条件下,_______________能使测定结果更准确(填“装置A”或“装置B”), 检查该装置气密性的操作是____________________________________。另一套装置测定结果不准确的主要原因是________________________________。
[观察生活]
(10)为防止过氧化钙在空气中变质,应____________保存。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组按下图实验测定部分变质的Na0H固体中Na2CO3的质量分数。

(1)根据题中信息_______(填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是初中化学中的一些常见实验,请回答相关问题。
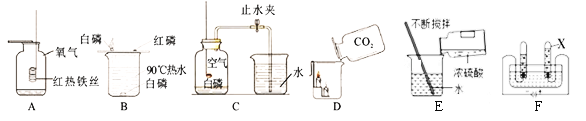
(1)A中的实验现象是_______________________;
(2)从B实验能得出燃烧条件之一是______________;
(3)C实验测定空气中氧气含量过程中,导致实验结果偏小的原因可能是_________(写一点)。
(4)通过D实验对CO2气体从物理性质和化学性质两个方面得到结论:物理性质___________(填一条即可),化学性质__________________(填一条即可)。
(5)E实验浓硫酸的稀释实验中,用玻璃棒搅拌的目的___________。
(6)F电解水实验中,在水中加入硫酸钠的作用是__________,X管中产生的气体是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com