
| 组别编号 | 样品质量(克) | 加入稀硫酸质量(克) | 剩余固体质量(克) |
| 1 | 10 | 20 | 8.4 |
| 2 | 10 | 30 | 8 |
分析 (1)分析题意可知:铜和氧化铜只有氧化铜和硫酸反应,第一次硫酸完全反应,固体减少的质量为(10g-8.4g)=1.6g,第二次加入硫酸固体的质量还会减少,说明剩余的固体含有铜和氧化铜.第二次硫酸有剩余,固体减少的质量为(8.4g-8g)=0.4g,说明硫酸有剩余,氧化铜全部反应.
(2)第二次剩余固体质量即为铜的质量,进一步计算铜的质量分数.
(3)根据铜的质量可求氧化铜的质量,结合方程式计算硫酸的质量,进一步计算稀硫酸溶质质量分数.
解答 解:(1)由题目给出的信息可知:铜和氧化铜只有氧化铜和硫酸反应,第一次硫酸完全反应,固体减少的质量为(10g-8.4g)=1.6g,第二次加入硫酸固体的质量还会减少,说明剩余的固体含有铜和氧化铜.第二次硫酸有剩余,固体减少的质量为(8.4g-8g)=0.4g,说明硫酸有剩余,氧化铜全部反应,剩余的固体只有铜.故答案为:铜和氧化铜(Cu和CuO);
(2)有题目给出的信息可知铜的质量是8g,铜的质量分数=$\frac{8g}{10g}$×100%=80%,故答案为:80%;
(3)由表格信息可知:第一次硫酸完全反应,第二次硫酸有剩余,因此需要用第一次的数据.
设硫酸的质量为x
CuO+H2SO4=CuSO4+H2O
80 98
10g-8.4g x
$\frac{80}{10g-8.4g}=\frac{98}{x}$
x=1.96g
硫酸的质量分数=$\frac{1.96g}{20g}$×100%=9.8%
答:稀硫酸溶质质量分数是9.8%.
点评 本考点是有关化学方程式的计算题,属于表格型计算题.近几年的中考计算题,题型多样,主要有表格题、图象题、标签题、图象和表格相联系的综合题以及与文字叙述题等,从不同的方面考查了学生的识图能力、分析能力和计算能力.同学们要认真把握.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 复合氧化物中Cu的化合价为+1和+2价 | |
| B. | 复合氧化物中Cu的化合价为+2和+3价 | |
| C. | 复合氧化物中+2价的Cu占铜的总量三分之一 | |
| D. | 复合氧化物中+3价的Cu占铜的总量三分之二 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
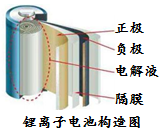 阅读下面科普短文.
阅读下面科普短文.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
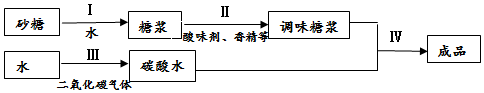
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Ca2+:表示钙离子显+2价 | |
| B. | H2O:表示说明水中有1个氢分子 | |
| C. | $\stackrel{+2}{Fe}$Cl2中正上方的“+2”:表示氯化铁中铁显+2价 | |
| D. | 2N2O中的系数“2”:表示2个一氧化二氮分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石油分馏出汽油、柴油 | B. | 将冰块制成冰雕 | ||
| C. | 铁矿石冶炼成生铁 | D. | 工业上从空气中分离出氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com