

| A.分离器中分离出的副产品是硫酸500℃ | ||||
| B.生产流程中能被循环利用的物质X为I2 | ||||
C.膜反应器中HI气体发生反应的化学方程式为2HX
| ||||
| D.该生产过程不仅能开发出氢能源,而且能实现可持续发展,不需再消耗能源 |
科目:初中化学 来源:2013-2014北京市朝阳区2014年中考一模化学试卷(解析版) 题型:填空题
(6分)金属具有广泛的应用。(1)下列金属制品中,利用金属导电性的是 (填字母序号).

(2)铁制品在沙漠地区不易锈蚀的原因是 。
(3)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为 。
(4)某小组同学在探究Mg、Cu、Fe三种金属的性质时进行了如图所示实验。

【实验一】发生反应的化学方程式为
。
【实验二】将实验一反应后的物质倒入烧杯
中,发现烧杯内的红色固体明显
增多,充分反应后过滤。
Ⅰ.下列对滤液中溶质成分的判断正确的是 (填字母序号)。
A.MgSO4 B.MgSO4、FeSO4 C.MgSO4、Fe2(SO4)3
D.CuSO4、FeSO4 E.MgSO4、FeSO4、CuSO4
Ⅱ.确定滤渣中所含物质成分的实验方案是 .
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.Fe3+,H+,OH-,SO42- | B.Zn2+,NH4+,OH-,Cl- |
| C.H+,Na+,OH-,CO32- | D.NO3-,K+,SO42-,Cu2+ |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
A.Fe
| ||||
B.CuO
| ||||
C.H2O
| ||||
D.CaCO3
|
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
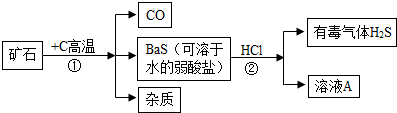
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | ______ | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量______ | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的______溶液 | ______ | 猜想成立 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com