B
分析:本题中没有告诉一个实际质量,只告诉一个生成氢气的质量比值,我们可以设这两个氢气的质量都为一个定值.根据这两个氢气的质量分别求出混合物中铝粉的质量和铁元素的质量,根据铝与铁的两种氧化物发生的还原反应化学方程式求出氧化亚铁中铁元素的质量和氧化铁中铁元素的质量,进而求出氧化亚铁的质量和氧化铁的质量.最后用氧化亚铁与氧化铁的质量比比上氧化亚铁与氧化铁的相对分子质量比,即可求出x与y的比值.
解答:设第一份与盐酸反应生成氢气的质量为5g,则第二份与盐酸反应生成氢气的质量为7g.
设铝粉与铁的氧化物反应还原出来的铁的质量为a,所用铝粉的质量为b
Fe+2HCl=FeCl
2+H
2↑ 2Al+6HCl=2AlCl
3+3H
2↑
56 2 54 6
a 5g b 7g
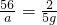
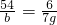
a=140g b=63g
设和氧化亚铁反应的铝的质量为m,生成铁的质量为n.

54 168
m n
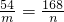
m=
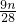
和氧化铁反应的铝的质量为63g-m,和氧化铁反应生成铁的质量为140g-n.

54 112
63g-m 140g-n
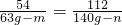
将m=
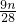
代入
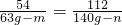
可解得n=28g
则氧化亚铁的质量=28g÷
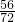
=36g
氧化铁中铁元素的质量=140g-28g=112g,氧化铁的质量=112g÷
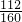
=160g
氧化亚铁与氧化铁的质量比为36:160,氧化亚铁与氧化铁的相对分子质量比为72:160
x:y=
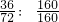
=1:2
故选B
点评:本道题目比较复杂,考查的内容比较多,难度也很大,题目中没有出现实际质量,我们可以设两个质量为定值将题简单化,题目在考查根据化学方程式计算的同时还考查了用代数上的方程组来解未知数,还有用
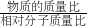
来求分子个数之比.

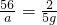
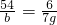

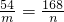
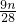

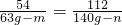
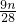 代入
代入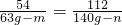
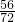 =36g
=36g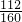 =160g
=160g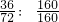 =1:2
=1:2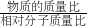 来求分子个数之比.
来求分子个数之比. 
