
工业上用煅烧石灰石制备二氧化碳。现有含杂质10%的石灰石100 t(杂质不参与反应,且不含钙元素),经高温煅烧后,若测得剩余固体中钙元素的质量分数为50%。
已知:CaCO3 CaO+CO2↑
CaO+CO2↑
通过计算回答:
(1)生成二氧化碳的质量。
(2)石灰石中的碳酸钙是否完全分解。
(1)28t (2)未完全分解
解析试题分析:已知:石灰石的质量为100t,杂质含量为10% 剩余固体中,钙元素的质量分数为50% 未知:二氧化碳的质量、参加反应的碳酸钙的质量
解题思路:钙元素的质量在化学反应中是不变的。1、可先求出原石灰石中钙元素的质量;2、利用钙元素的质量求出剩余固体的质量;3、利用反应前后固体质量的变化求出生成二氧化碳气体的质量;4、利用反应的化学方程式求出参加反应的碳酸钙的质量;5、判断碳酸钙是否完全反应。
解:石灰石中碳酸钙的质量:100t×(1-10%)=90t
石灰石中钙元素的质量:90t×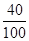 ×100%=36t
×100%=36t
剩余固体的质量: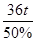 =72t
=72t
生成二氧化碳的质量:100t-72t=28t
设消耗碳酸钙的质量为x。
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
x 28t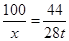
x≈63.6t
因为63.6t<90t,所以石灰石中碳酸钙未完全分解。
答:生成二氧化碳的质量为28t,石灰石中碳酸钙未完全分解。
考点:根据化学式的计算、根据化学方程式的计算


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:计算题
(9分)火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:
2CaCO3(粉末)+2SO2+O2==2CaSO4+2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)80%的
石灰石多少克。
(2)处理上述100克废气,可得到含CaSO485%的粗产品多少克。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
钛(Ti)是一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。在一定条件下,钛可以由四氯化钛(TiCl4)和金属镁反应而制得:TiCl4 + 2Mg  Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)
Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某工厂利用废硫酸和废铁屑起反应来制取硫酸亚铁.现有废硫酸9.8t(H2SO4的质量分数为10%)与足量的铁屑起反应,理论上可生产FeSO4的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室里有一瓶固体烧碱因吸收了空气中的二氧化碳而部分变质。为测定这瓶烧碱的纯度,称取该样品20g,溶于水配成溶液,向其中逐滴加入氯化钡溶液至沉淀完全,反应过程中生成沉淀的质量与所用氯化钡溶液质量关系如图所示。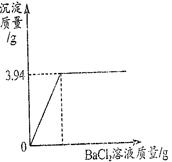
(1)从图中可以看出,反应产生的沉淀最多是 g。
(2)该烧碱样品中碳酸钠的质量是多少g?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小强对当地的石灰石矿石样品进行检测,取用100g这种石灰石样品,把300g稀盐酸分3次加入,实验过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)下表中m的数值应该为 。
(2)样品中碳酸钙的物质的量是 mol。
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 100 | 60 |
| 第2次 | 100 | m |
| 第3次 | 100 | 12 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小明想测定某石灰石样品中碳酸钙的质量分数,他取一块石灰石样品,将其敲碎后,称出6g放入烧杯内(烧杯质量为20 g)加入50 g某一定溶质质量分数的稀盐酸,用玻璃棒搅拌充分反应至不再产生气泡为止。反应所需时间(t)与烧杯内剩物质的总质量(m)的关系如图所示
试回答:
(1)将石灰石样品敲打粉碎的目的是
(2)反应结束后共产生二氧化碳质量是多少?
(3)石灰石样品中碳酸钙的质量分数是多少?(5分)(保留到1%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某瓶装保健食品的外包装标签上的部分文字如下图。某同学为了测定该保健食品中CaCO3的质量分数,进行了如下实验:将100片该食品放入一烧杯中,再向其中注入120g(足量)的稀盐酸,直到不再产生气泡时,测得烧杯内剩余物质的总质量为150.2g。(注:该保健食品中其它成分不与盐酸反应)
请你根据以上数据计算:
(1)反应生成气体(CO2)的质量为多少克?
(2)该保健食品中CaCO3的质量分数为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
(6分)鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测 定鸡蛋壳中碳酸钙的含量,做如下实验: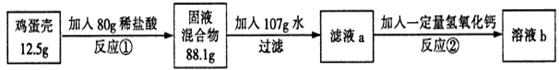
反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应。请回答下列问题:
(1)反应①的化学方程式为___________________________;
(2)根据已知条件列出求解碳酸钙质量(X)的比例式______________;
(3)该鸡蛋壳中碳酸钙的质量分数为_______;
(4)所加氢氧化钙的质量为_______;
(5)溶液b中溶质的质量分数为_______;
(6)用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com