
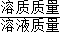 ×100%”计算即可.
×100%”计算即可.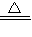 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑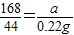 ,
, ,
,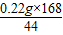 =0.84g,
=0.84g,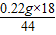 =0.09g,
=0.09g,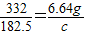
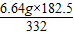 =3.65g;
=3.65g;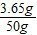 ×100%=7.3%.
×100%=7.3%.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:2012年第二十二届“天原杯”全国初中学生化学素质和实验能力竞赛模拟试卷(解析版) 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:
某种天然碱样品的化学式可以用xNaHCO3·yNa2CO3·zH2O表示(式中x、y、z是最简整数比)。取50克某一浓度的盐酸与3.32克样品充分反应,能生成1.32克CO2气体。
(1)若改用1.66克样品与50克这种盐酸反应,能产生 克CO2。
(2)另取3.32克样品在300℃下加热至完全分解(已知Na2CO3在300℃时不会分解),能产生0.22克CO2和0.45克H2O,试确定该样品的化学式: 。
(3)写出这种天然碱与盐酸完全反应的化学方程式。若6.64克天然碱样品与50克该盐酸充分反应时放出的CO2最多,求该盐酸的溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com