
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:初中化学 来源: 题型:
| 品牌代号 | 口味 | 滴入碘标准溶液的滴数 | ||
| 第一次 | 第二次 | 第三次 | ||
| A | 鲜橙味 | 25 | 24 | 23 |
| 混合味 | 18 | 20 | 22 | |
| B | 鲜橙味 | 35 | 33 | 38 |
| 混合味 | 29 | 30 | 30 | |
| C | 鲜橙味 | 27 | 25 | 26 |
| 烧杯编号 | 同种果汁体积 | 恒温露置时间 | 温度 | 碘溶液滴数 |
| 1 | 30mL | 10min | 室温 | 80 |
| 2 | 30mL | 10min | 40℃ | 76 |
| 3 | 30mL | 10min | 50℃ | 71 |
| 4 | 30mL | 20min | 50℃ | 65 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 品牌 | 口味 | 滴入碘标准溶液的滴数 | ||
| 第一次 | 第二次 | 第三次 | ||
| 健力宝第五季 | 鲜橙味 | 25 | 24 | 23 |
| 混合味 | 18 | 20 | 22 | |
| 统一 | 鲜橙味 | 35 | 33 | 38 |
| 混合味 | 29 | 30 | 30 | |
| 酷儿 | 鲜橙味 | 27 | 25 | 26 |
| 烧杯编号 | 同种果汁体积 | 恒温露置时间 | 温度 | 碘溶液滴数 |
| 1 | 30毫升 | 10分钟 | 室温 | 80 |
| 2 | 30毫升 | 10分钟 | 40℃ | 76 |
| 3 | 30毫升 | 10分钟 | 50℃ | 71 |
| 4 | 30毫升 | 20分钟 | 50℃ | 65 |
查看答案和解析>>
科目:初中化学 来源: 题型:

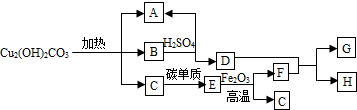
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
| 品牌代号 | 口味 | 滴入碘标准溶液的滴数 | ||
| 第一次 | 第二次 | 第三次 | ||
| A | 鲜橙味 | 25 | 24 | 23 |
| 混合味 | 18 | 20 | 22 | |
| B | 鲜橙味 | 35 | 33 | 38 |
| 混合味 | 29 | 30 | 30 | |
| C | 鲜橙味 | 27 | 25 | 26 |
| 烧杯编号 | 同种果汁体积 | 恒温露置时间 | 温度 | 碘溶液滴数 |
| 1 | 30mL | 10min | 室温 | 80 |
| 2 | 30mL | 10min | 40℃ | 76 |
| 3 | 30mL | 10min | 50℃ | 71 |
| 4 | 30mL | 20min | 50℃ | 65 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com