
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;该反应属于放热反应.
(2)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O;溶液由无色变为黄色.
(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;冶炼生铁的主要设备是高炉.
(4)NaHCO3溶液与稀硫酸反应生成硫酸、水和二氧化碳,反应的化学方程式为2NaHCO3+H2SO4═Na2SO4+H2O+2CO2↑;该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应.
(5)硫酸铵固体与熟石灰混合研磨生成硫酸钙、水和二氧化碳,反应的化学方程式是为:(NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O;生成的氨气可用湿润的红色石蕊试纸检验,若变蓝,说明是氨气.
故答案为:(1)CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;放热;
(2)Fe2O3+6HCl═2FeCl3+3H2O;黄色;
(3)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;高炉;
(4)2NaHCO3+H2SO4═Na2SO4+H2O+2CO2↑;复分解反应;
(5)(NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O;湿润的红色石蕊.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.


科目:初中化学 来源: 题型:解答题
| 实 验 操 作 | 现 象 | 结 论 |
| (1)在氢氧化钠溶液的烧杯中,滴加2-3滴酚酞试液,用胶头滴管逐滴滴加盐酸,边滴边搅拌. | 溶液刚好由红色变成无色. | 反应中碱的特性消失了(溶液不呈碱性) |
| (2)取实验1 所得少量溶液于试管中,向其中加入一滴氢氧化钠溶液. | 溶液由无色变成红色 | 反应中酸的特性消失了. |
(3)取变色硅胶、无水醋酸和氢氧化钠固体进行如下图所示的三个实验.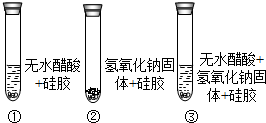 | ①②中硅胶不变红,③中硅胶变红 | 反应生成了水. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学是在原子、分子、离子水平上研究物质及其变化的科学.
化学是在原子、分子、离子水平上研究物质及其变化的科学.| 抗胃酸药 | 复方氢氧化镁片 | 铝碳酸镁片 |
| 有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
| 构成微粒 | Mg2+、OH- | Al3+、Mg2+、OH-、CO32- |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 3O-3个氧元素 | B. | $\stackrel{+3}{Fe}$-1个铁离子 | ||
| C. | O3-3个氧原子 | D. | SO3-1个三氧化硫分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |


查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com