
����Ŀ����֪���ڸ���������������ͭ��Ӧ��2Fe+3CuO ![]() Fe2O3+3Cu��ͭ���Ȼ�����Һ�з�����Ӧ��Cu+2FeCl3�T2FeCl2+CuCl2 �� һ����������������ͭ�Ļ����ڸ���������ǡ����ȫ��Ӧ������Ӧ��Ĺ����ĩ����ʢ������ϡ������ձ��У�����ַ�Ӧ���ã�Ȼ����ձ���ȡ������Һ����ʾΪ���ס������Թ��У�������һ��������п�ۣ���ַ�Ӧ����ˣ��õ���Һ�Һ�����������ж���ȷ���ǣ� ��
Fe2O3+3Cu��ͭ���Ȼ�����Һ�з�����Ӧ��Cu+2FeCl3�T2FeCl2+CuCl2 �� һ����������������ͭ�Ļ����ڸ���������ǡ����ȫ��Ӧ������Ӧ��Ĺ����ĩ����ʢ������ϡ������ձ��У�����ַ�Ӧ���ã�Ȼ����ձ���ȡ������Һ����ʾΪ���ס������Թ��У�������һ��������п�ۣ���ַ�Ӧ����ˣ��õ���Һ�Һ�����������ж���ȷ���ǣ� ��
�ټ��в���FeCl3
�ڼ��к���FeCl3
������������ϡ������������������Һ����һ������ZnCl2��FeCl2 �� ���ܺ���CuCl2������������ϡ�������������������Һ���п��ܺ���ZnCl2��FeCl2 �� һ��������CuCl2 ��
A.�٢�
B.�ڢ�
C.�٢�
D.�ڢ�
���𰸡�A
���������⣺��2Fe+3CuO ![]() Fe2O3+3Cu��Fe2O3+6HCl�T2FeCl3+3H2O��Cu+2FeCl3�T2FeCl2+CuCl2��֪��ͭ���Ȼ�����Ӧʱͭ���������к����Ȼ��������Ȼ�ͭ��
Fe2O3+3Cu��Fe2O3+6HCl�T2FeCl3+3H2O��Cu+2FeCl3�T2FeCl2+CuCl2��֪��ͭ���Ȼ�����Ӧʱͭ���������к����Ȼ��������Ȼ�ͭ��
����Ϊͭ���ˣ���˼��в����Ȼ�������ѡ��˵����ȷ��
�ڼ��в������Ȼ�������ѡ��˵������ȷ��
������������ϡ������������������Һ����һ������ZnCl2��FeCl2 �� ���ܺ���CuCl2 �� ��ѡ��˵����ȷ��
����Һ����һ�����з�Ӧ���ɵ��Ȼ�п����ѡ��˵������ȷ��
��ѡ��A��
�����㾫����������Ŀ����֪���������ý������ϵ�ѡ�����ݵ����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���պ�ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ�������������������


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ࡢ��������к��зḻ������п�����������пӦ����Ϊ�� ��
A.ԭ��
B.Ԫ��
C.����
D.��������п
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ƣ���ѧʽΪNa2O2����һ��dz��ɫ�����ĩ�����������������Ĺ������������˺����Ķ�����̼��Na2O2��Ӧ�ų�O2 �� �����˵�������������÷�Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2CO2�T2Na2CO3+O2 �� ijͬѧ���ø÷�Ӧԭ����ȡ�������������ͼһ��ʾ��ʵ��װ�ã� 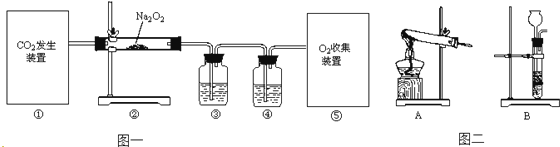
��1��װ�â���CO2����ȡ�����ж��֣�����ϡ�����ʯ��ʯ��ȡCO2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ �� ���ü���NaHCO3������ȡCO2 �� Ӧ��ѡ�õķ���װ��Ϊ��ѡ��ͼ������ĸ����ͬ����
��2��Ϊ�ռ����������O2 �� װ�â���ʢ�ŵ��Լ�Ϊ��װ�â���ʢ�ŵ��Լ���������������ռ�������ѡ�� ��
A����ˮ������ B�������ſ����� C�������ſ����� D����մ��ռ���
��3�����۲쵽װ�â���ʱӦֹͣͨCO2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȼ���и��������壬һ�����ᷢ����ը���ǣ� ��
A.������̼������
B.һ����̼�Ϳ���
C.Һ��ʯ�����Ϳ���
D.��Ȼ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ���Ŵ�ƻ�2013��ȡ�������߿�ѧ�������������о��Ļ��ȼ�ϳ��õ��������Ǹ�����泥�NH4ClO4�������е�Ԫ�صĻ��ϼ�Ϊ��3�ۣ�����Ԫ�صĻ��ϼ��ǣ� ��
A.��1
B.+3
C.+5
D.+7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�CaO2����һ�ְ�ɫ������������ˮ�Ĺ��壬��ɱ���������㷺���ڹ��߱��ʡ�������������ˮ�����ȷ��森ij��ȤС��ͬѧ�������̽����һ�������Ƶ������о�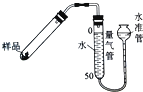
��1��ȡ�����������Ʒ����Թ��У�������ˮ��������ɫ���ݣ��������ǵ�ľ������Թ��У��۲쵽�����ǵ�ľ�� �� ˵������������ˮ��Ӧ���������ɣ�
��2���ֱ�ȡʵ�飨1�����ú���ϲ���Һ��������֧�Թ��У�������һ֧�Թ��е����̪��Һ��������Һ��ɺ�ɫ��˵����Һ���ԣ�����һ֧�Թ���ͨ�������̼����Һ����ǣ�˵������������ˮ��Ӧ���������������ɣ�
���ۣ��������ƺ�ˮ��Ӧ�����������ƺ�������
��3�����������Ƶ��Ʊ��о�
ʵ�����ø����Ʊ�CaO2 �� ����Ҫʵ��װ�ã�ͼ1�������̣�ͼ2�����£�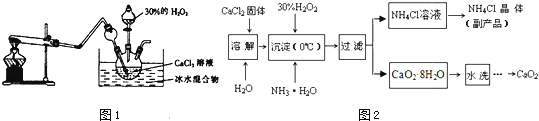
ͼ1�Թ��е�������NH4Cl��Ca��OH��2 �� ����ʱ������Ӧ����CaCl2��NH3 ��H2O����Ӧ�Ļ�ѧ����ʽΪ ��
��4����������ʱ�����ķ�ӦΪ��CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O��+2NH4Cl����Ҫ�����¶���0�����ң����õIJ����ǽ���Ӧ�����������У���Ӧ�¶Ȳ��ܹ��ߵ�ԭ���ǣ��ٷ�ֹ��ˮ�ӷ�����
��5�������ˡ����õĸ���ƷNH4Cl���������е����ʣ����顰ˮϴ���Ѿ�ϴ���ķ����ǣ�ȡ���һ��ϴ��Һ�������Թ��У� ��
��6�����ȷֽⷨ�DzⶨCaO2��Ʒ���ȵij��÷���֮һ��2CaO2![]() 2CaO+O2������
2CaO+O2������
��ͼ��ʵ���Ҳⶨ��Ʒ��CaO2���ȵ�װ�ã�ʵ�鲽�裺���װ�õ������ԡ�װ��ҩƷ0.30g�����������ܺ�ˮ������ˮλ��ƽ������������������ų�����ȴ�����£����������ܺ�ˮ������ˮλ��ƽ�����������ظ�2�Σ�ȡƽ��ֵ�����㣮����֪�����¶Ⱥ�ѹǿ�µ�O2�ܶ�Ϊ1.43g/L��
�����±����ݣ�����CaO2��Ʒ���ȣ���д��������̣���
��� | ��Ʒ���� | V��O2��/mL |
��һ�� | 0.30 | 28.2 |
�ڶ��� | 0.30 | 28.0 |
������ | 0.30 | 27.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����мȱ�ʾһ��Ԫ�أ��ֱ�ʾ��Ԫ�ص�һ��ԭ�ӣ�����ʾһ�ֵ��ʵ��ǣ� ��
A.N
B.O2
C.CO2
D.Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݱ���Ԫ�غ��Ļ��ϼۣ�д���������ʵĻ�ѧʽ��
Ԫ�غ��ķ��� | Fe | O | CO3 |
���ϼ� | +3 | ��2 | ��2 |
������ �� ̼���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com