解:(1)一般来说,无论用哪种方法制取气体,在成套装置组装完毕,装入反应物之前,都必须检查装置气密性,已确保实验的顺利进行;
(2)过氧化氢在二氧化锰的催化作用下的分解反应,其化学方程式为:2H
2O
2
2H
2O+O
2↑;
(3)在加热高锰酸钾时,由于热空气的带动,一些高锰酸钾的小颗粒会顺着试管往下跑.从而会堵塞导管引起试管爆裂.所以要在试管口塞棉花团;
(4)如果装置B中的反应很剧烈,短时间内产生的气体太多,容易发生爆炸,应该采取的安全措施是控制阀门,调整滴加速度,使反应减缓;
(5)用A装置制备气体应考虑的因素是反应物的状态和反应条件(或是否是固固加热型);
(6)二氧化碳密度比空气略大,能溶于水,并生成碳酸.故收集时需用向上排空气法.小明同学B装置制取二氧化碳,在检验是否生成二氧化碳时,结果没出现他预期的现象,可能是他没有用向上排气法收集CO
2,或者是生成的二氧化碳溶于水变成了碳酸.
(7)解:生成CO
2的质量为:158.0g+100g-253.6g=4.4g,
设参加反应的纯碱的质量为x,
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 44
x 4.4g
∴
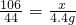
解之得:x=
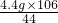
=10.6g;
该产品中碳酸钠的质量分数为:
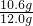
×100%=88.3%.
答:该产品中碳酸钠的质量分数为88.3%.
故答案为:(1)检查装置气密性;
(2)2H
2O
2
2H
2O+O
2↑;
(3)一团棉花;
(4)控制阀门,调整滴加速度(答案合理即可);
(5)反应物的状态和反应条件(或是否是固固加热型)(答案合理即可);
(6)生成的CO
2溶于水,没有用向上排气法收集CO
2;
(7)4.4g;88.3%
分析:(1)根据制取气体的装置要求分析解答;
(2)二氧化锰是催化剂,不参与反应,故此反应是过氧化氢在二氧化锰的催化作用下的分解反应,生成对应元素的物质;
(3)根据高锰酸钾的性状和实验的注意事项分析解答;
(4)短时间内气体体积膨胀,容易发生爆炸;
(5)用A装置制备气体的高锰酸钾是固体,据此考虑;
(6)根据二氧化碳的性质分析;
(7)根据质量守恒定律,生成二氧化碳的质量=反应前物质质量总和-反应后物质质量总和;然后利用碳酸钠与盐酸反应的化学方程式和生成二氧化碳的质量,列出比例式,就可计算出参加反应的纯碱(碳酸钠)的质量,再根据质量分数公式计算即可.
点评:本题可分为两个部分,(1)~(6)为一部分,主要考查学生的实验操作能力;(7)为一部分,主要考查学生利用化学方程式进行计算的能力.两种题型都是中考的重要题型,需要学生熟练掌握实验操作流程,计算时要认真,细心.


 2H2O+O2↑;
2H2O+O2↑;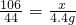
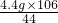 =10.6g;
=10.6g;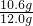 ×100%=88.3%.
×100%=88.3%. 2H2O+O2↑;
2H2O+O2↑;

 名校课堂系列答案
名校课堂系列答案