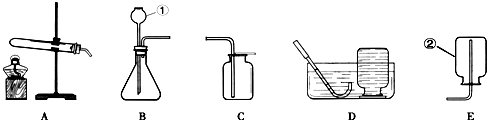
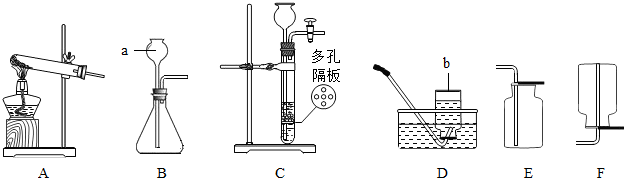
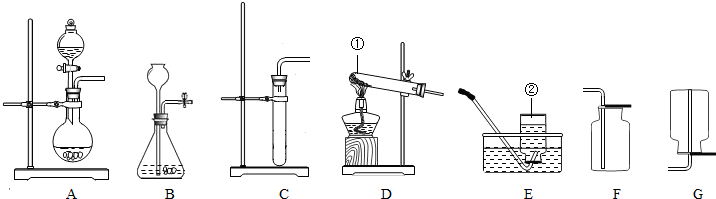
集气瓶 A,C(或A,D) CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑ 发生 不能 二氧化锰是粉末状固体 ② 0.8
分析:①根据仪器特点判断仪器名称;
②根据反应物状态和反应条件选择发生装置,根据气体的密度和溶解性选择收集装置;
③奇普发生器适合块状固体和液体在常温下反应,并可控制反应速度;
④从影响化学反应速率因素分析,反应物的接触面积越大,反应越快;
⑤根据质量守恒定律求出氧气的质量,根据化学方程式,可求出过氧化氢的物质的量,从而可求出溶液的质量分数.
解答:①仪器a名称为:集气瓶;
②氯酸钾和二氧化锰都是固体,反应条件是加热,发生装置选择A,氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,故装置选择A,C或A,D;
③装置B适合块状固体和液体常温下反应,并可控制反应速度,可制取二氧化碳,反应的化学方程式为:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;B装置图示的反应发生;因为二氧化锰为粉末状固体,
用二氧化锰和双氧水混合制氧气时不能选用装置B;
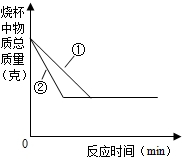
④同质量的碳酸钙与相同质量的稀盐酸反应时,块状比粉末状固体和盐酸的接触面积小,反应速率慢;所以粉末状反应比较快,斜率大,所以粉末碳酸钙和盐酸反应所对应的曲线是②;
⑤根据质量守恒定律可知:产生氧气的质量=50g+3g-52.2g=0.8g;
Ⅰ、氧气的物质的量=0.8g÷32g/mol=0.025mol;
设生成0.025mol氧气需要过氧化氢的物质的量为x
2H
2O
2
2H
2O+O
2↑
2 1
x 0.025mol

x=0.05 mol;
Ⅱ、H
2O
2质量为:0.05×34=1.7(g)
H
2O
2质量分数=
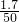
×100%=3.4%.
故答案为:①集气瓶;
②A,C(或A,D);
③CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;发生,不能,二氧化锰是粉末状固体;
④②;
⑤0.8克;
氧气的物质的量=0.8g÷32g/mol=0.025mol;
设生成0.025mol氧气需要过氧化氢的物质的量为x
2H
2O
2
2H
2O+O
2↑
2 1
x 0.025mol

x=0.05 mol;
Ⅱ、H
2O
2质量为:0.05×34=1.7(g)
H
2O
2质量分数=
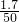
×100%=3.4%.
点评:明确气体的发生装置和收集装置选择依据,会根据化学方程式进行计算,在了解影响反应速率的因素的基础上,理解函数图象表示的意义,要能比较两种曲线表示的速率快慢和质量大小.

 2H2O+O2↑
2H2O+O2↑
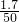 ×100%=3.4%.
×100%=3.4%. 2H2O+O2↑
2H2O+O2↑
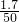 ×100%=3.4%.
×100%=3.4%.