
【题目】铝合金是汽车制造中的重要材料之一,查阅资料可知:氢氧化铝沉淀可与氢氧化钠溶液反应,产生可溶性的偏铝酸钠,反应如下: ![]() 。某学习小组取7.8 g该合金粉末加入200.0g过量的盐酸中(假设合金中的其他成分不参与反应),向充分反应后的物质中加入过量20.0%的氢氧化钠溶液。整个实验过程的数据如图所示:
。某学习小组取7.8 g该合金粉末加入200.0g过量的盐酸中(假设合金中的其他成分不参与反应),向充分反应后的物质中加入过量20.0%的氢氧化钠溶液。整个实验过程的数据如图所示:
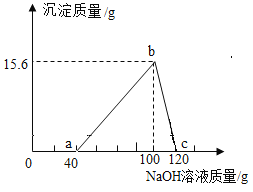
根据图示回答以下问题:
(1)b点时,溶液中的溶质为____________(写化学式)。
(2)该合金中铝的质量为____________g。
(3)加入盐酸的溶质质量分数为____________? (请写出计算过程)
科目:初中化学 来源: 题型:
【题目】碘是人体必需的微量元素之一,有“智力元素”之称。图1为碘在元素周期表中的相关信息及碘原子的结构示意图,图2为A、B、C、D四种粒子的结构示意图,据此回答下列问题:
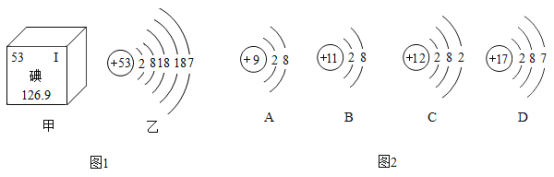
(1)碘是一种_________________________(填“金属”或“非金属")元素,碘原子的核外有_________________________个电子层,碘原子的核电荷数为_________________________。
(2)在化学反应中,碘原子一般容易_________________________(填“得到”或“失去”)电子,与A、B、C、D四种粒子中的_________________________(填字母)化学性质相似。
(3)A、B、C、D四种粒子中属于离子的是._________________________(填字母),C、D两种粒子在一定条件下结合成化合物的化学式是_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国劳动人民早在五千年前就会使用木炭炼铜,在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又可用改进的微型实验装置(见图乙)。化学兴趣小组采用图乙装置,开展以下探究活动。

(1)写出木炭与氧化铜反应的化学方程式________________________,其中发生还原反应的物质是________。
(2)判断木炭与氧化铜已经发生反应的依据是______________________________________________________。
(3)使用图乙装置与使用图甲装置相比,其优点是__________(写出一条即可)。
(4)用甲装置进行实验,完毕后先停止加热,可能引起的后果是__________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对实验现象及结论的描述错误的是
A.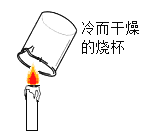 观察到烧杯内壁有水珠产生,说明蜡烛中一定含有氢元素和氧元素
观察到烧杯内壁有水珠产生,说明蜡烛中一定含有氢元素和氧元素
B.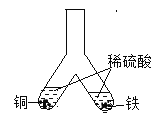 装有铁粉的支管中产生气泡,装有铜粉的支管中无明显现象,说明金属活动性顺序Fe>Cu
装有铁粉的支管中产生气泡,装有铜粉的支管中无明显现象,说明金属活动性顺序Fe>Cu
C.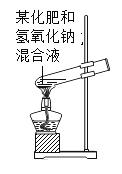 将某化肥和氢氧化钠溶液混合加热,能闻到刺激性气味,说明该化肥是铵态氮肥
将某化肥和氢氧化钠溶液混合加热,能闻到刺激性气味,说明该化肥是铵态氮肥
D.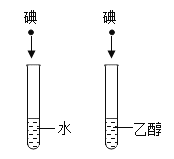 盛有水的试管中碘不溶解,盛有乙醇的试管中碘溶解,说明物质的溶解性与溶剂的种类有关
盛有水的试管中碘不溶解,盛有乙醇的试管中碘溶解,说明物质的溶解性与溶剂的种类有关
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某固体可能含有铁粉、碳粉、氧化铜、氢氧化钠、氯化钾中的一种或几种。为探究其组成成分,某化学兴趣小组进行了如下实验:取一定量该固体样品,加入足量的水溶解,经过滤后可得到滤液A和滤渣甲。现对滤液A和滤渣甲进行如下操作:
①向滤液A中加入过量的硝酸铜溶液得到溶液B,此过程中观察不到明显现象。再向溶液B中加入一定量硝酸银溶液,观察到有白色沉淀生成,过滤后可得到白色滤渣乙和滤液C。
②向滤渣甲中加入过量的稀盐酸,经过滤后可得到滤液D和滤渣丙,将滤渣丙在空气中充分灼烧,发现仍有固体物质残留。
请回答下列问题:
(1)该实验中生成白色沉淀滤渣乙的化学方程式为_________________。
(2)滤液D中一定含有_________________。
(3)原固体中一定不含有的物质是_______________,证据是__________________;原固体中一定含有的物质是_______________。
(4)实验结束后,该兴趣小组将滤液C和滤液D都倒入废液缸,有白色沉淀生成,已知上层清液E中不含氯离子,则E中一定含有的溶质是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图中A是碘元素在元素周期表中的信息,B﹣E是四种粒子的结构示意图。 请回答。
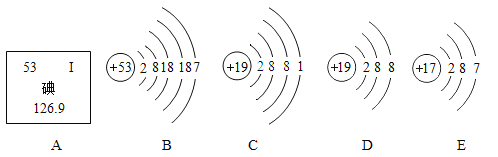
(1)碘的相对原子质量是_____; B是碘原子的结构示意图,碘离子的符号为_____。
(2)B~E四种粒子中,属于同种元素的粒子是_____(填字母,下同),化学性质相似的粒子是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用。电瓶的正极材料是二氧化铅(PbO2),负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:PbO2(固)+2H2SO4+Pb=2PbSO4(固)+2H2O。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
(1)电瓶在放电时,_________能转化为电能。
(2)假如某个电瓶中铅的质量为1800 g,内装36%的稀硫酸1200 g,当有310.5 g的铅参加反应时,需消耗稀硫酸中溶质_____克?此时电瓶中硫酸溶液溶质的质量分数是_____?(最后结果精确到0. 01%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组的同学在实验室整理化学药品时,发现一瓶金属铬。为了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,他们进行了如下探究活动。
(查阅资料)铬(Cr)是银白色金属,在空气中表面能形成致密的氧化膜。
(提出假设)考虑到铝的活动性比铜强,提出了三种假设:
假设①:Al>Cr>Cu;假设②:Cr>Al>Cu;假设③:__。
(实验过程)Ⅰ.取大小相同的Cr、Cu、Al三种金属薄片,用砂纸打磨光亮。
Ⅱ.将Cr、Cu、Al三种金属分别放入三支试管中,再分别加入等体积的20%的稀硫酸。
(实验现象)
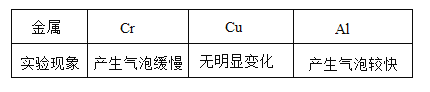
(实验结论)假设__(填序号)成立。
(问题与反思)(1)由上述结论可知,铬可以与硫酸铜溶液发生反应。请写出该反应的化学方程式:__(已知在该反应的生成物中铬元素显+2价)。
(2)小静提出,按上述实验操作,用硫酸铜溶液代替稀硫酸也能得出三种金属的活动性顺序,你认为__(填“可行”或“不可行”),理由是__。
(总结与归纳)由上述实验得出比较金属活动性强弱的方法有:
①______;②________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,将等质量的a、b两种不含结晶水的固体物质,分别加入到盛有lO0g水的烧杯中,充分搅拌后,现象如图甲;然后升温到50℃时.现象如图乙;a、b两种物质的溶解度曲线如图丙。由这一过程可知()
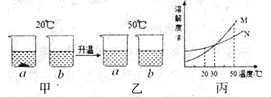
A.图甲中a溶液溶质质量分数比b溶液大a
B.图乙中a、b溶液一定都是饱和溶液
C.图丙中表示a的溶解度曲线是M
D.30℃时a、b溶液溶质质量分数不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com