
分析 (1)根据铁能与酸反应分析;
(2)根据铁能与硫酸铜反应生成硫酸亚铁和铜,可观察到铁丝表面出现红色固体,溶液由蓝色逐渐变为无色.
(3)根据反应物、生成物和反应条件及质量守恒定律的两个原则结合相关信息写出正确的化学方程式即可.
解答 解:(1)铁的活动性在H的前面,能与酸反应,所以酸菜等酸性的食物不宜用铁质器具长期盛放;
(2)为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质.由此可知该零件“发蓝”处理效果不好;如果氧化膜不致密,裸露出来的铁与硫酸铜的反应生成了铜和硫酸亚铁,反应的化学方程式为Fe+CuSO4 ═FeSO4 +Cu;
(3)该过程是铁粉与盐酸反应的过程,铁和稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe+2HCl═FeCl2+H2↑.
故答案为:
(1)铁会与酸反应而使铁质器具被腐蚀;
(2)不好;Fe+CuSO4=Cu+FeSO4
(3)Fe+2HCl═FeCl2+H2↑.
点评 本题考查的是金属活动顺序表的应用及金属的锈蚀等,要能应用必须先把金属活动顺序表熟练的掌握住.金属的知识是重要的内容,应加强学习.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源: 题型:解答题
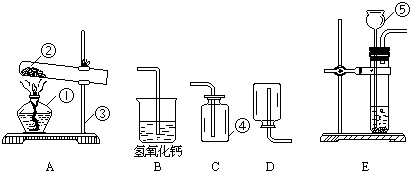
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
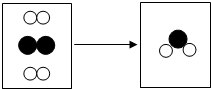 图是某化学反应的微观粒子示意图.(1)两种反应物的共同之处是:每个分子都是由两个相同的原子构成的
图是某化学反应的微观粒子示意图.(1)两种反应物的共同之处是:每个分子都是由两个相同的原子构成的 B.两个
B.两个 C.一个
C.一个 D.两个
D.两个
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
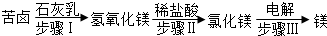

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com