
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:初中化学 来源: 题型:

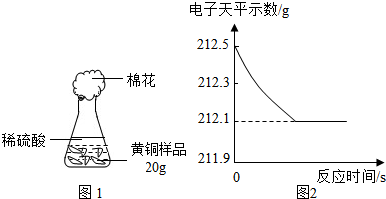
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
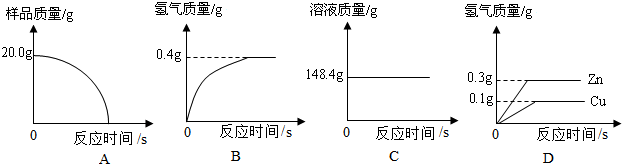
 某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,并进行中和反应的有关实验.请你与他们一起完成以下探究活动:
某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,并进行中和反应的有关实验.请你与他们一起完成以下探究活动:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 氢氧化钠 | 氯化钠 | 氢氧化钙 | 碳酸钠 | |
| 溶解度/g(20℃) | 51 | 36 | 0.16 | 21.5 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品溶液于试管中,滴加 稀盐酸 稀盐酸 . |
有气泡产生 有气泡产生 |
该溶液是碳酸钠溶液. 有关反应的化学方程式为: Na2CO3+2HCl═2NaCl+H2O+CO2↑ Na2CO3+2HCl═2NaCl+H2O+CO2↑ . |
查看答案和解析>>
科目:初中化学 来源: 题型:
图1是甲、乙两种固体物质的溶解曲线,图2是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图像和有关信息判断,下列说法中错误的是
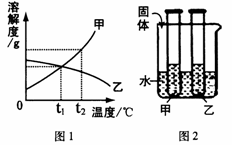
A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为:甲>乙
B.将甲、乙两种物质的饱和溶液都从t2℃降至将甲、乙两种物质的饱和溶液都从t2℃降至t1℃时,两种溶液中溶质的质量分数相等时,两种溶液中溶质的质量分数相等
C.向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小
D.向烧杯的水加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 金属镁将成为二十一世纪大有前途的绿色金属材料.
金属镁将成为二十一世纪大有前途的绿色金属材料.| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com