
科目:初中化学 来源: 题型:选择题
| A. | 某黑色固体能使红墨水褪色,则该固体一定是活性炭 | |
| B. | 向某溶液中滴加紫色石蕊溶液,溶液变蓝,則该溶液一定是碱溶液 | |
| C. | 将燃着的木条伸入集气瓶内.木条火焰立即熄灭,则该瓶气体一定是二氧化碳 | |
| D. | 将干冷的烧杯罩在蜡烛火焰上方,烧杯内壁有水雾,证明蜡烛中一定含有氢元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
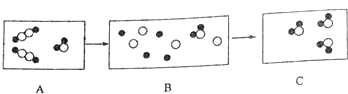 如图用●代表氢原子,〇代表氧子,这两种元素组成的化合物在一定条件下能发生以下反应,反应前后的微观模拟图如下:
如图用●代表氢原子,〇代表氧子,这两种元素组成的化合物在一定条件下能发生以下反应,反应前后的微观模拟图如下:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaCl、KNO3.(NH4)2SO4 | B. | HC1、AgNO3.Na2SO4 | ||
| C. | KMnO4、CuCl2、Fe2(SO4)3 | D. | H2SO4、K2CO3、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量分数 | 48% | 25% | 10% | 17% |
| 反应后质量分数 | 30% | 41% | 10% | 19% |
| A. | 丁一定是化合物 | |
| B. | 该反应可能是碳酸钙分解 | |
| C. | 丙一定是该反应的催化剂 | |
| D. | 甲物质中元素的种类等于乙和丁物质中元素种类之和 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,加水溶解,往上层溶液中滴加无色酚酞 | 溶液显红色 | 变质的熟石灰中仍含氢氧化钙 |
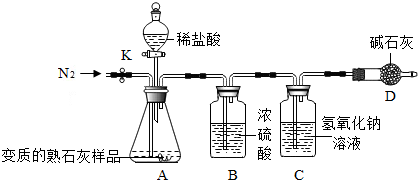
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com