解:
(1)①氧化物:由两种元素组成且其中一种是氧元素的化合物,如CaO;
②酸:电离时产生的阳离子全都是氢离子的化合物,如HCl;
③碱:电离时产生的阴离子全都是氢氧根离子的化合物,如Ca(OH)
2;
④盐:电离时生成金属阳离子(或NH4)和酸根离子的化合物,如CaCl
2;
(2)①分解反应:符合AB=A+B,如碳酸分解的化学方程式为H
2CO
3═H
2O+CO
2↑;
②复分解反应:符合AB+CD=AD+CB,如碳酸钙与盐酸反应的方程式为CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(3)参加反应的盐酸溶质的质量是60g×10%=0.6g
设参加反应的碳酸钙质量是X
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 73
X 0.6g
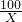
=
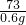
X=0.8g
药品中该盐的质量分数等于碳酸钙的质量除以药品的质量,不知道药品的质量,所以计算不出碳酸钙的质量分数.
故答案为:
(1)①CaO;②HCl;③Ca(OH)
2;④CaCl
2;
(2)①H
2CO
3═H
2O+CO
2↑;
②CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(3)0.8g;不知道药品的质量.
分析:(1)①氧化物:由两种元素组成且其中一种是氧元素的化合物,如二氧化碳,一氧化碳,氧化钙等;
②酸:电离时产生的阳离子全都是氢离子的化合物,如盐酸、硫酸、碳酸等;
③碱:电离时产生的阴离子全都是氢氧根离子的化合物,如氢氧化钙、氢氧化钠等;
④盐:电离时生成金属阳离子(或NH4)和酸根离子的化合物,如碳酸钠、氯化钙,硝酸铵等;
(2)①分解反应:一种化合物在特定条件下分解成二种或二种以上物质的反应;可简记为AB=A+B;如电解水,碳酸分解;
②复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应;可简记为AB+CD=AD+CB;如氢氧化钙溶液与盐酸反应,碳酸钙与盐酸反应;
(3)碳酸钙是一种不溶于水的盐,再根据碳酸钙与盐酸反应的方程式进行计算,无法得出药品中该盐的质量分数,其原因是不知道样品的质量.
点评:本题主要考查了化学方程式的书写和应用,及分解反应和复分解反应及其应用和对氧化物、酸、碱、盐的概念的理解、应用,要掌握相关知识才能正确解答.

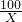 =
=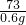


 名校课堂系列答案
名校课堂系列答案