解:(1)①铝在常温下与空气中的氧气发生反应,其表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化,反应的化学方程式为:4Al+3O
2=2Al
2O
3.
②高温条件下一氧化碳能把铁从磁铁矿石(主要成分为Fe
30
4)中还原出来生成铁和二氧化碳,反应的化学方程式为Fe
3O
4+4CO

3Fe+4CO
2.
③“曾青得铁则化为铜”,其中的“曾青”是指硫酸铜,这句话的意思就是说:硫酸铜溶液遇到金属铁时,铁与硫酸铜发生置换反应能生成金属铜,该反应的化学方程式为Fe+CuSO
4=Cu+FeSO
4.
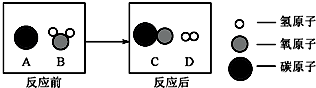
(2)①由反应的过程图可知,反应由1个碳原子与1个水分子反应生1个成氢分子和1个一氧化碳分子,因此反应的化学方程式为:C+H
2O═CO+H
2,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应.
②由反应的过程图可知,该反应生成物的分子个数比为1:1.
(3)①NH
3中氮元素和氢元素的质量比为14:(1×3)=14:3.
②根据反应的化学方程式,反应物中氮、氢、氧原子个数分别为4、12、6,反应后的生成物中氮、氢、氧原子个数分别为0、12、6,根据反应前后原子种类、数目不变,则2个未知生成物的分子中含有4个氮原子,则每个未知生成物的分子由2个氮原子构成,则物质X的化学式为N
2.
故答案为::(1)①4Al+3O
2=2Al
2O
3;②Fe
3O
4+4CO

3Fe+4CO
2;③Fe+CuSO
4=Cu+FeSO
4;
(2)①置换反应;②1:1.
(3)①14:3;②N
2.
分析:(1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(2)根据反应过程图中的分子,判断反应物与生成物的,写出反应的化学方程式,根据反应特征确定反应类型和反应生成物的分子个数比.
(3)①根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
②由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断未知生成物的化学式.
点评:本题难度不大,掌握化学方程式的书写方法、利用化学反应前后原子守恒来确定物质的化学式、从微观的角度分析物质的变化等是正确解题的关键.

 化学与人类的生活和社会发展密切相关.
化学与人类的生活和社会发展密切相关. 6H2O+2______.
6H2O+2______. 3Fe+4CO2.
3Fe+4CO2. 3Fe+4CO2;③Fe+CuSO4=Cu+FeSO4;
3Fe+4CO2;③Fe+CuSO4=Cu+FeSO4;
