
| ||
| ||
| ||
| ||
| ||
| ||

| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32g | 反应前55.72g | 反应前 281.00g |
| 反应后55.08g | 反应后 281.56g |
| ||
| ||
| ||
| ||
| ||
| ||
| 0.64g |
| 2.32g |
| 16×4 |
| 56×3+16×4 |
| 16×3 |
| 56×2+16×3 |
| 16 |
| 56+16 |
| ||
| ||
| ||
| ||
| ||


科目:初中化学 来源:2013届江苏省南京市玄武区初三第一学期期末学情调研化学试卷(带解析) 题型:问答题
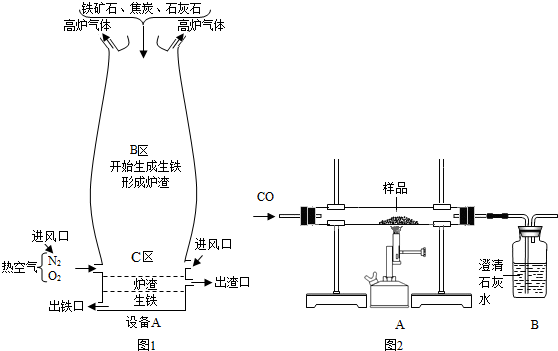
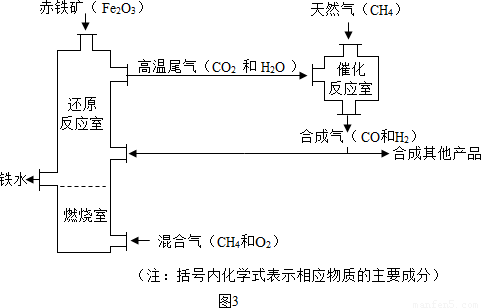
铁的冶炼是钢铁工业的基础。
(Ⅰ)右图是教材中炼铁高炉及炉内化学变化过程示意图,若右图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:
(1) B区 (2) C区 、 。
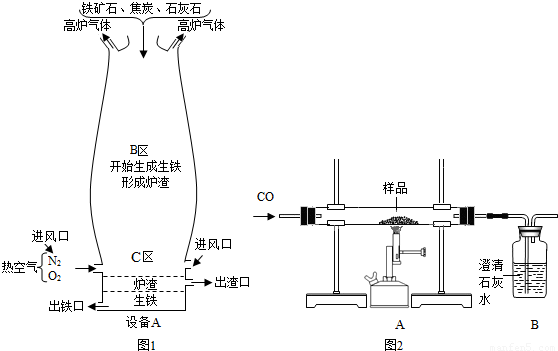
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如下图所示。
(3)该工艺流程中,甲烷的作用是 、 ,冶炼出的铁水属于 (填“纯净物”或“混合物”)。
(4)该工艺流程中,可循环利用的物质是 。
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法。
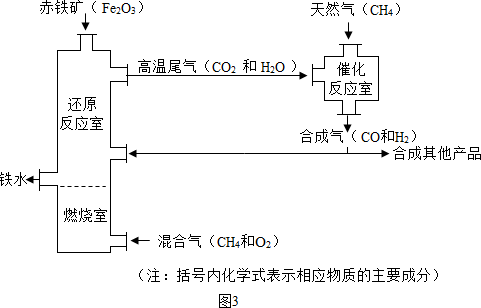
(Ⅳ)某兴趣小组同学利用下图装置进行相关实验,测定样品的组成:
(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32 g | 反应前55.72 g | 反应前 281.00 g |
| 反应后55.08 g | 反应后 281.56 g |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省南京市玄武区初三第一学期期末学情调研化学试卷(解析版) 题型:简答题
铁的冶炼是钢铁工业的基础。
(Ⅰ)右图是教材中炼铁高炉及炉内化学变化过程示意图,若右图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:

(1) B区 (2) C区 、 。
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如下图所示。

(3)该工艺流程中,甲烷的作用是 、 ,冶炼出的铁水属于 (填“纯净物”或“混合物”)。
(4)该工艺流程中,可循环利用的物质是 。
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法。

(Ⅳ)某兴趣小组同学利用下图装置进行相关实验,测定样品的组成:

(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
|
样品质量 |
装置A中玻璃管和固体的总质量 |
装置B的质量 |
|
2.32 g |
反应前55.72 g |
反应前 281.00 g |
|
反应后55.08 g |
反应后 281.56 g |
请回答下列问题:
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是 。
②该样品所有可能的组成是 。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题



| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32g | 反应前55.72g | 反应前 281.00g |
| 反应后55.08g | 反应后 281.56g |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省南京市玄武区九年级(上)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com