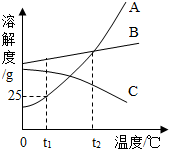
有一包Na2SO4和Na2CO3的固体混合物,为测定Na2SO4的质量分数,称取样品10g放入45g水中使其完全溶解,再逐滴加入溶质质量分数为9.8%的稀硫酸,边加边振荡,至不再放出气泡时,刚好消耗50g稀硫酸.试计算:(结果保留一位小数)
(1)所用稀硫酸中溶质H2SO4质量.
(2)样品中Na2SO4的质量分数.
(3)反应后所得溶液中溶质的质量分数.
解:(1)所用稀硫酸中溶质H
2SO
4的质量为50 g×9.8%=4.9g;
(2)设混合物中Na
2CO
3的质量为x,生成Na
2SO
4的质量为y,生成CO
2的质量为yz
Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
106 98 142 44
x 4.9g y z
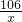
=
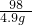
x=5.3g
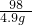
=
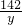
y=7.1g
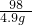
=
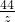
z=2.2g
所以样品中Na
2SO
4的质量分数=
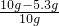
×100%=47%
(3)反应后所得溶液溶质质量分数=
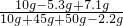
×100%=11.5%
答:稀硫酸中溶质H
2SO
4的质量为4.9g,样品中Na
2SO
4的质量分数是47%,反应后所得溶液溶质质量分数11.5%.
分析:(1)根据溶质的质量=溶液的质量×溶质的质量分数解答;
(2)混合物中能与稀硫酸反应生成气体的是Na
2CO
3,据消耗的稀硫酸的质量中溶质的质量结合方程式计算出混合物中Na
2CO
3的质量,进而求出Na
2SO
4的质量及其质量分数;
(3)反应后溶液为Na
2SO
4的质量溶液,据方程式计算出生成的Na
2SO
4的质量,并据溶质的质量分数计算.
点评:解答时注意分析清楚混合物中参加反应的物质,以及反应后溶液中溶质的质量包括生成的硫酸钠、还有混合物中的硫酸钠.

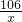 =
=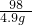 x=5.3g
x=5.3g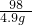 =
=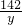 y=7.1g
y=7.1g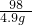 =
=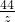 z=2.2g
z=2.2g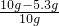 ×100%=47%
×100%=47%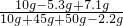 ×100%=11.5%
×100%=11.5%