
| A. | 饭菜变质 | B. | 铁制菜刀生锈 | C. | 人的呼吸 | D. | 火药燃烧爆炸 |
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:初中化学 来源: 题型:选择题
| A. | 小麦可以磨成粉 | B. | 大楼是由一块一块的砖砌成的 | ||
| C. | 糖块放入一杯水里会逐渐消失 | D. | 石头沉入大海中看不见了 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 为防止药品滴在桌面上,胶头滴管可伸入试管内部滴加液体 | |
| B. | 用量筒取13.37mL的稀硫酸 | |
| C. | 给试管内液体加热时,液体体积不超过试管容积的$\frac{1}{3}$ | |
| D. | 向酒精灯内添加酒精时,不能超过酒精灯容积的$\frac{2}{3}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
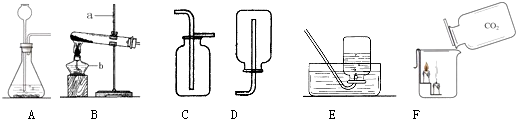
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 实验步骤 | 实验现象 | 燃烧反应的文字表达式 |
| A | ①硫在空气中燃烧 | ①发出淡蓝色火焰并产生有刺激味气体 | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
| ②硫在氧气中燃烧 | ②发出蓝紫色火焰并产生有刺激味气体 | ||
| B | ③铁在空气中燃烧 | ③无法点燃 | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 |
| ④铁在氧气中燃烧 | ④火星四射,放出热量并生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com