解:
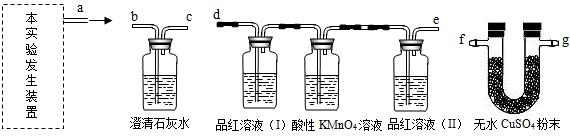
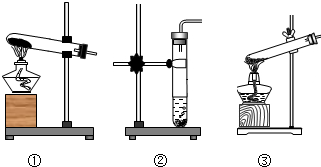
(1)反应物是浓硫酸与焦炭在加热的条件下进行,故发生装置选③;
(2)验证三种产物,文理科达到预期的实验目的,要验证水蒸气,然后验证二氧化硫,最后检验二氧化碳,这样做能避免造成不必要的干扰;
(3)无水硫酸铜变蓝说明生成水,品红溶液( I)和酸性高锰酸钾溶液都褪色说明生成了二氧化硫,酸性KMnO
4溶液的作用是除去S0
2,品红溶液(Ⅱ)不褪色,说明 S0
2已除尽;装置B中发生反应是二氧化碳和石灰水反应,化学方程式是 C0
2+Ca(OH)
2=CaC0
3↓+H
20;
(4)验证二氧化碳时要确认没有二氧化硫的干扰,根据二氧化碳能使石灰水变浑浊的性质验证,根据反应物和生成物书写化学方程式,注意反应条件和配平;根据质量守恒定律分析张辉同学提出的观点.
故答案为:(1)③(2)f-→g-→d-→e→b(,f、g顺序可颠倒)
(3)H
20(水) S0
2(二氧化硫)
除去S0
2 S0
2已除尽 C0
2+Ca(OH)
2=CaC0
3↓+H
20
(4)装置C中品红溶液(Ⅱ)不褪色,装置B中澄清石灰水变浑浊(只答对其中一点,不给分)
【实验结论】成立,C+2H
2SO
4(浓)

2S0
2↑+C0
2↑+2H
2O
【交流讨论】支持,①根据质量守恒定律,反应前后元素种类不变,②碳的氧化物有CO和C0
2分析:(1)根据反应物的状态和条件判断发生装置;
(2)根据实验目的和气体的性质连接实验装置;
(3)水能使无水硫酸铜变蓝,二氧化硫能使品红褪色并和高锰酸钾溶液反应,二氧化碳能使石灰水变浑浊;
(4)根据二氧化碳的性质和质量守恒定律分析填空.
点评:二氧化碳和二氧化硫都能使石灰水变浑浊,所以在本题中检验二氧化碳时要排除二氧化硫的干扰.


 2S02↑+C02↑+2H2O
2S02↑+C02↑+2H2O

 通城学典默写能手系列答案
通城学典默写能手系列答案



 x Fe+y H2O,Fe3C+2H2
x Fe+y H2O,Fe3C+2H2 3Fe+CH4.
3Fe+CH4.
 3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).

 x Fe + y H2O,Fe3C + 2H2
x Fe + y H2O,Fe3C + 2H2 3 Fe + CH4。
3 Fe + CH4。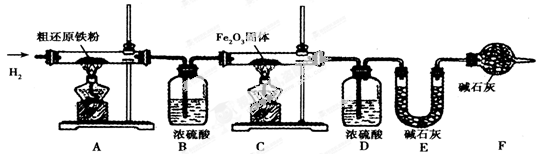
 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。