
分析 首先要知道F可使澄清石灰水变浑浊,且F是气体,所以F是二氧化碳,再根据A和E燃烧生成二氧化碳,且B是黑色固体,所以B是碳,E是氧气,再根据制氧气的方法进行判断即可.
解答 解:二氧化碳具有能使澄清石灰水变浑浊的特点,所以由F可使澄清石灰水变浑浊,且F是气体,所以F是二氧化碳,再根据B和E燃烧生成二氧化碳,且B是黑色固体,所以B是碳,E是氧气,制取氧气的方法有以下几种:过氧化氢溶液与二氧化锰制取氧气,氯酸钾和二氧化锰制取氧气,高锰酸钾制取氧气,而高锰酸钾是紫黑色的,过氧化氢溶液是液体,氯酸钾是白色固体,生成的氯化钾也是白色固体,所以C是氯酸钾,D是氯化钾,通过表达式可知B是催化剂且是黑色固体,所以A是二氧化锰.
故答案为:MnO2;C;KClO3;KCl;O2;CO2.
点评 要知道使澄清石灰水变浑浊的气体是二氧化碳,常见的黑色固体有:二氧化锰、碳、四氧化三铁、铁粉等,还需知道实验室制取氧气的几种方法.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶质质量分数 | B. | 最多能吸收二氧化碳的质量 | ||
| C. | 溶液的pH | D. | 氢氧化钠的溶解度 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分别加入澄清石灰水 | |
| B. | 闻气体的气味 | |
| C. | 分别将燃着的小木条伸入三瓶气体中 | |
| D. | 观察气体的颜色 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
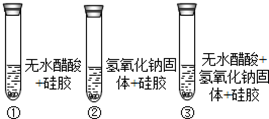
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
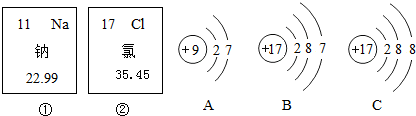
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 炼钢、气焊和宇宙航行等都要用到氧气 | |
| B. | 氦可用于制造低温环境 | |
| C. | 氧气支持燃烧,具有可燃性 | |
| D. | 氮气用于磁悬浮列车 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
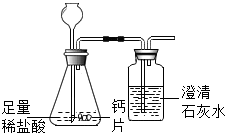 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com