
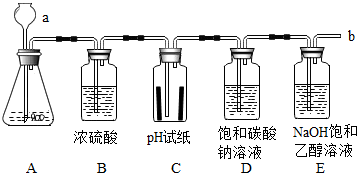
 某学习小组用下列装置进行CO2的制取及性质探究实验.
某学习小组用下列装置进行CO2的制取及性质探究实验.分析 (1)认识常见仪器的名称,根据实验室中制取二氧化碳的原理以及二氧化碳的性质来分析;
(2)根据二氧化碳能与水反应生成碳酸,碳酸显酸性来分析;
(3)根据题意,将CO2通入Na2CO3溶液中,只生成NaHCO3,写出反应的化学方程式即可;
(4)根据题干信息,碳酸钠在乙醇中几乎不溶解来分析.
解答 解:(1)仪器a是长颈漏斗,大理石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳不燃烧也不支持燃烧,所以在b处检验是否有CO2逸出的操作为将燃着的木条放在导管口,观察木条是否熄灭;故填:长颈漏斗;CaCO3+2HCl=CaCl2+H2O+CO2↑;将燃着的木条放在导气管口;
(2)湿的pH试纸上有水,二氧化碳和水反应生成碳酸,碳酸显酸性,故pH约为6,而干燥的pH试纸上没有,二氧化碳不能使之变色;故填:二氧化碳与水反应生成碳酸,碳酸显酸性;
(3)将CO2通入Na2CO3溶液中,只生成NaHCO3,反应的化学方程式为:CO2+H2O+Na2CO3═2NaHCO3.故答案为:CO2+H2O+Na2CO3═2NaHCO3;
(4)氢氧化钠与二氧化碳反应生成碳酸钠和水,而碳酸钠在乙醇是不溶解的,所以看到出现白色沉淀,故填:出现白色沉淀;2NaOH+CO2=Na2CO3+H2O.
点评 本题考查了仪器的名称、二氧化碳的实验室制取方法、二氧化碳的性质以及化学方程式的书写,难度不大.


科目:初中化学 来源: 题型:选择题
| A. |  常温下,稀释KOH溶液 | |
| B. |  甲烷和过量的氧气在密闭容器中完全反应 | |
| C. | 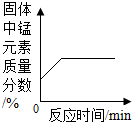 加热一定质量高锰酸钾固体 | |
| D. |  在装有稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
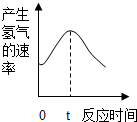 探究影响化学反应速率的因素
探究影响化学反应速率的因素| 观察或测量的量 | 选用的仪器 | 实验步骤 | 实验现象 | 实验结论 |
| 产生相同体积(一试管)的气体所需时间 | 气体发生装置、秒表、胶头滴管、水槽、大试管、 药匙、量筒 | 温度越高,反应速率越快.反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )| A. | t1℃时甲的饱和溶液,升温至t2℃时仍是饱和溶液 | |
| B. | 乙的溶解度随温度的升高而增大 | |
| C. | 相同温度时,甲的溶解度一定大于乙的溶解度 | |
| D. | 分别将甲、乙的饱和溶液从t2℃降至t1℃时,所得溶液中溶质的质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 农村直接焚烧秸秆肥田 | B. | 大力发展电动汽车,实现节能减排 | ||
| C. | 远离烟草、拒绝毒品 | D. | 改进燃煤炉灶,促进燃料充分燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水是人们生活生产中应用最多的物质:
水是人们生活生产中应用最多的物质:查看答案和解析>>
科目:初中化学 来源: 题型:多选题
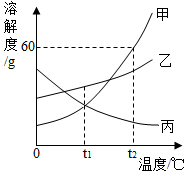 图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )| A. | t1℃时,三种固体物质的溶解度关系为乙>甲=丙 | |
| B. | t2℃100g甲物质饱和溶液中含有60g甲 | |
| C. | 将丙物质饱和溶液变为不饱和溶液,可采用升温的方法 | |
| D. | t2℃时,分别用100g水配制甲、乙的饱和溶液,再降温到t1℃,析出无水晶体的质量:甲>乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 收集满一试管的纯净气体,用燃着的木条伸入试管内 | 气体没有燃烧,木条熄灭 | 猜想(1)(2)不成立 |
| 将气体通入装有澄清石灰水的试管中 | 澄清石灰水变浑浊 | 猜想(3)成立,其反应方程式为SO2+Ca(OH)2=CaSO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com