


科目:初中化学 来源: 题型:
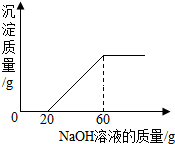 某混合溶液中含有氯化铜和稀盐酸,向其中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示:
某混合溶液中含有氯化铜和稀盐酸,向其中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、氯吡苯脲由5种元素组成 |
| B、氯吡苯脲中元素的质量比为12:10:1:3:1 |
| C、其相对分子质量为609.5g |
| D、它是一种氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com