解:(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;故答案为:除去合金表面的氧化膜
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,所以是④①③②,故答案为:④①③②
(3)在乳胶管上夹上弹簧夹,向量气管加适量水,提高量气管,一段时间后,若量气管内液面不下降,说明气密性良好.故答案为:水;观察到液面不再下降
(4)待B中不再有气体产生,记录C的液面位置前,需将温度恢复至室温和关闭分液漏斗的活塞;故答案为:关闭分液漏斗的活塞
(5)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,故答案为:D
(6)铜锌合金的质量为ag,若a为0.4g,V为80mL,则氢气的质量=0.08L×0.09g/L=0.0072g,根据化学方程式的计算可以求出锌的质量是0.234g,从而可以求得铜的质量分数=

=41.5%,故答案为:41.5%
(7)实验过程中,若未冷却就读取气体体积,体积会偏大,计算出的锌的质量分数也会偏大,故答案为:偏大
(8)利用上述实验装置,测量结果总会偏小,原因是有一部分氢气留在试管和导管中;改进方法是:可以加水把氢气赶过去.故答案为:有一部分氢气留在试管和导管中;可以加水把氢气赶过去
分析:实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理;注意读数的方法;在乳胶管上夹上弹簧夹,向量气管加适量水,提高量气管,一段时间后,若量气管内液面不下降,说明气密性良好.测定铜锌合金中锌、铜的质量分数,可以依据锌能与酸反应生成氢气而铜不可以来进行;要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度;铜锌合金的质量为ag,若a为0.4g,V为80mL,则氢气的质量=0.08L×0.09g/L=0.0072g,从而可以求得铜的质量分数;利用上述实验装置,测量结果总会偏小,原因是有一部分氢气留在试管和导管中;改进方法是:可以加水把氢气赶过去.
点评:本题探究了铜锌合金中铜和锌的质量分数的测定,完成此题,可以依据铜和锌的性质,根据题干提供的信息进行.有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.

 某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量) =41.5%,故答案为:41.5%
=41.5%,故答案为:41.5%

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.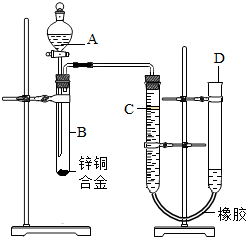 (2012?宝应县二模)某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
(2012?宝应县二模)某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)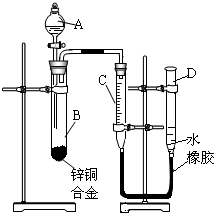 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.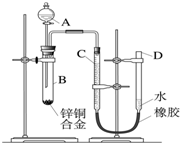 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.