
化学兴趣小组在化学实验室发现了一瓶已部分变质的氢氧化钠溶液,想测试它的变质情况。小组同学取10g该溶液放入烧杯中,然后将20g稀盐酸分4次加入同一个烧杯中充分反应,反应后称量质量。
变质的 分四次 每次反应后
NaOH溶液 加入稀盐酸 称量质量
实验过程的数据记录如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 5 | 5 | 5 | 5 |
| 反应后烧杯内物质的质量 | 15 | 19.56 | 24.12 | 29.12 |
(1)HCl和NaCl
(2) Na2CO3 +2HCl=" 2NaCl+" H2O+ CO2↑
(3) 106/44 =x/0.88g
(4)14.6%
(5)2:1
(6)11.7%
解析试题分析:氢氧化钠易与空气中的二氧化碳反应生成碳酸钠,向已部分变质的氢氧化钠溶液中加入盐酸,根据酸碱盐间的反应,加入的稀盐酸先与氢氧化钠反应,氢氧化钠反应完全后再与碳酸钠反应。根据实验过程的数据记录可知,当第二次加入稀盐酸与碳酸钠反应生成了二氧化碳气体0.44g,第三次加入盐酸后生成的二氧化碳气体的质量为0.88g,第四次生成的二氧化碳的质量仍为0.88g,那么说明第三次加入盐酸后碳酸钠已完全反应,生成二氧化碳的总质量为0.88g,即第四次加入的盐酸没有参加反应,故第四次实验后溶液中溶质是HCl和NaCl。根据二氧化碳的质量利用化学方程式可计算出碳酸钠的质量;根据第二次或第三次生成的二氧化碳的质量可求出参加反应的盐酸的溶质质量分数。
(3)设碳酸钠的质量为x,生成的氯化钠的质量为b;
Na2CO3 +2HCl=" 2NaCl+" H2O+ CO2↑
106 117 44
X b 0.88g
106/44 =x/0.88g 117/44 =b/0.88g
X=2.12g b=2.34g
(4)设第三次所加稀盐酸的溶质质量为y,
Na2CO3 +2HCl=" 2NaCl+" H2O+ CO2↑
44
Y 0.44g
73/44 =y/0.44g
y=0.73g
所用稀盐酸的溶质质量分数=0.73g/5g ×100% =14.6%
(5)设变质的氢氧化钠的质量为z ;未变质的氢氧化钠的质量为a;盐酸与氢氧化钠反应生成的氯化钠的质量为c;
2NaOH+CO2==Na2CO3+H2O HCl+NaOH==NaCl+H2O
80 106 36.5 40 58.5
Z 2.12g 0.73g a c
80/106 =z/2.12g 36.5/40 =0.73g/a 36.5/58.5 =0.73g/c
Z=1.6g a=0.8g c=1.17g
氢氧化钠溶液中变质的氢氧化钠与剩余氢氧化钠的质量比=1.6g:0.8g=2:1
(6)生成的氯化钠的质量为:2.34g+1.17g=3.51g
反应后溶液加水后的质量=10g+15g+5.88g-0.88g=30g
第三次反应后的溶液中,再加入5.88g水,所得溶液中溶质的质量分数为:
3.51g/30g ×100%=11.7%
答:略
考点:利用化学方程式的计算、有关溶质质量分数的计算


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:初中化学 来源: 题型:计算题
(7分)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%)。某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g。NaOH中氧元素的质量分数 是 。
(2)在实验室用如图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数)。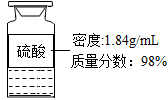
(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g。通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定某BaCl2溶液的溶质质量分数,现取100gBaCl2溶液,不断加入稀H2SO4,反应过程中溶液质量与加入稀H2SO4的质量关系如图所示,(反应方程式:BaCl2+H2SO4=BaSO4↓+2HCl)请回答: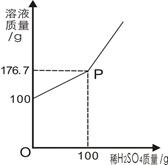
(1)P点意义_______________。
(2)反应生成BaSO4沉淀的质量为_________g。
(3)求原BaCl2溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(10分)某兴趣小组分别向80.00 g 10%的NaOH溶液中加入体积不同、质量分数相同的盐酸,充分反应后,将所得溶液加热蒸发,直到固体完全析出且没有任何变化后,再研细、烘干、称量;重复将固体烘干、称量,直至称得的固体质量不再发生变化。实验测得,向80.00 g10%的NaOH溶液中加入80.00 mL盐酸时,溶液恰好呈中性,其它测得的部分数据则如下表所示: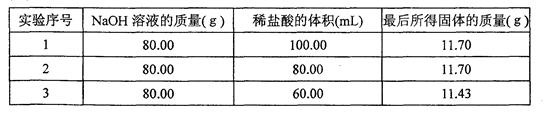
(1)加热蒸发所得溶液时需要用玻璃棒不断搅拌,其目的是: ;
(2)向80.00 g 10%NaOH溶液中加入盐酸的体积为100.00 mL时,最后所得固体的质量仍为11.70 g,其原因是: ,
(3)列式求出向80.00 g 10%NaOH溶液中加入40.00 mL盐酸时,最后所得固体中NaCl的质量分数(小数点后保留两位)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分)课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
| 蒸发皿的质量(g) | 25.0 |
| 蒸发皿+食盐溶液(g) | 45.0 |
| 蒸发皿+食盐晶体(g) | 27.4 |
| 数据处理 | 溶液的溶质质量分数为 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
(1)下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的 (填甲或乙)图所示进行的。
②曲线上M点表示 。
③向烧杯中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为 色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为 (结果精确到0.1%)。
(2)为证明中和反应是放热反应,某小组进行了如图所
示的实验操作: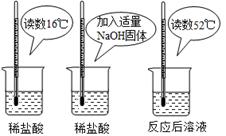
根据上图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应。乙同学认为:甲同学得出
这个结论的依据不科学,理由是 。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、
D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,
再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。为测定水垢中碳酸钙的含量,将足量质量分数为10.0%的盐酸加到10.0 g水垢中,产生CO2气体的情况如图所示。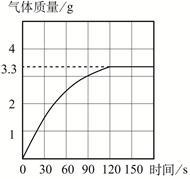
(1)水垢中碳酸钙的质量分数是多少?
(2)假设水垢中除碳酸钙和氢氧化镁外,不含其它杂质,溶解10.0 g水垢,至少需要质量分数为10.0%的盐酸的质量是 。(结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定某含有少量NaCl的纯碱晶体(Na2CO3?nH2O)样品的组成,做了如下实验:
根据实验数据进行计算,写出计算过程。
(1)样品中含有结晶水的质量是 克。
(2)原混合物中NaCl与纯碱晶体(Na2CO3?nH2O)的质量比 。
(3)化学式Na2CO3? nH2O中n= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com