
分析 ①据该温度下硝酸钾的溶解度解答;
②据该温度下硝酸钾的溶解度及溶质质量分数计算方法解答;
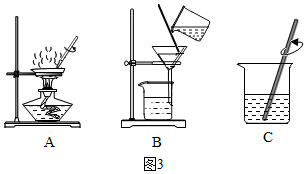
③硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,提纯硝酸钾可用冷却热饱和溶液的方法,操作Ⅲ是将硝酸钾晶体和溶液分开,固液分离用过滤,滤液中含有未析出的硝酸钾和氯化钠;
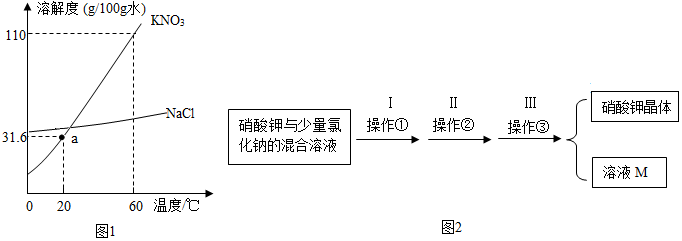
④20℃时氯化钠的溶解度大于硝酸钾的溶解度,所以20℃时,将等质量的NaCl、KNO3 固体分别加入到盛有100g水的烧杯中,充分搅拌后有剩余固体的 是硝酸钾;
并据氯化钠的溶解度随温度变化情况分析判断.
解答 解:①a点表示20℃时硝酸钾的溶解度是31.6g,即在100g水 中最多溶解硝酸钾31.6克;
②60℃时硝酸钾的溶解度是110g,则50克水中加入55克硝酸钾恰好形成饱和溶液,再往该溶液中加入115克水后,溶质的质量不变,硝酸钾溶液的溶质质量分数是:
$\frac{55g}{55g+50g+115g}$×100%=25%;
③硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,提纯硝酸钾可用冷却热饱和溶液的方法,操作Ⅲ是将硝酸钾晶体和溶液分开,固液分离用过滤,滤液中的溶质是硝酸钾和氯化钠;
④20℃时氯化钠的溶解度大于硝酸钾的溶解度,所以20℃时,将等质量的NaCl、KNO3 固体分别加入到盛有100g水的烧杯中,充分搅拌后有剩余固体的 是硝酸钾;
Ⅰ.由图示可知:20℃时乙烧杯中氯化钠完全溶解,而氯化钠的溶解度随温度升高而增大,所以从20℃升温到60℃过程中,溶质质量没有改变,正确;
Ⅱ.20℃时,甲烧杯中固体有剩余,说明加入溶质的质量一定小于31.6g,故其中溶质与溶剂的质量比不是31.6:100,故错误;
Ⅲ.将溶液从20℃降温,氯化钠的溶解度基本不变,依然大于31.6g,故降温不会析出晶体,故错误;
Ⅳ.氯化钠的溶解度随温度升高而增大,所以升温到60℃时,乙烧杯中溶液一定是不饱和溶液,正确;
故答案为:①100克水;
②55; 25%;
③B;KNO3、NaCl;
④KNO3;Ⅰ、Ⅳ.
点评 解答本题关键是要知道溶解度的四要素,并能灵活运用解决实际问题,熟悉溶质质量分数的计算方法,溶解度曲线的意义及其应用,能灵活运用相关知识解答相关问题.


科目:初中化学 来源: 题型:多选题
| A. | 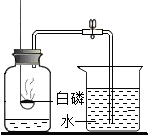 研究空气中氧气含量 | B. | 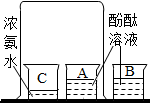 研究分子的运动 | ||
| C. | 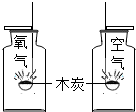 研究木炭在氧气中燃烧 | D. | 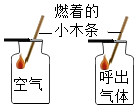 研究空气和呼出气体中氧气的含量 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是某化学反应的微观示意图,“
如图是某化学反应的微观示意图,“ ”、“
”、“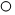 ”代表不同元素的原子.有关描述错误的是( )
”代表不同元素的原子.有关描述错误的是( )| A. | 反应物均为单质 | |
| B. | 化学变化的实质是原子重新组合 | |
| C. | 反应前后元素的存在形态发生改变 | |
| D. | 该示意图可以反映电解水的微观过程 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 水是地球上一种最普通、最常见的物质.
水是地球上一种最普通、最常见的物质.| 实验编号 | a | b | c | d |
| 加入KNO3固体的质量 | 45 | 50 | 55 | 60 |
| 所得溶液的质量 | 95 | 100 | 105 | 105 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
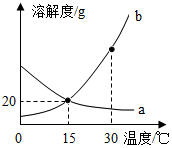 a、b两种物质的溶解度曲线如图所示.下列叙述不正确的是( )
a、b两种物质的溶解度曲线如图所示.下列叙述不正确的是( )| A. | 25℃时,b比a更易溶于水 | |
| B. | 30℃时,将a、b的饱和溶液分别降温至15℃,两溶液的溶质质量分数相等 | |
| C. | 30℃时,a的饱和溶液可以通过降温方法变为不饱和溶液 | |
| D. | 15℃时,b的饱和溶液中溶质与溶剂的质量比为1:5 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
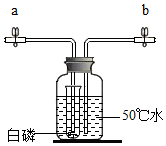 用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.
用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中的少量CO | 点燃 |
| B | 比较吸入的空气与呼出的气体中二氧化碳气体的含量 | 向呼出气体样品中加入少量的澄清石灰水,振荡 |
| C | 鉴别氧气和二氧化碳 | 观察颜色 |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com