
| 甲 | 乙 | 丙 | |
| 金属混合物的质量 | 10 | 10 | 20 |
| 稀硫酸的质量/g | 100 | 120 | 100 |
| 剩余固体质量/g | 4 | 4 | 13 |
分析 (1)根据金属的活动性关系铁>氢>铜,铁能与稀硫酸反应生成硫酸亚铁同时放出氢气,而铜不能与稀硫酸反应,当把金属混合物放入足量稀硫酸中充分反应时,剩余固体为铜,而金属混合物中铁的质量为混合物质量与铜质量差.由丙可知100g硫酸能与7g铁粉反应,所以甲中只与6g铁反应,说明硫酸过量,所以反应后溶质是硫酸亚铁和硫酸;
(2)根据剩余固体质量为铜的质量,再计算铜的质量分数;
(3)由甲、乙两同学实验数据对比知,10g金属混合物中铁已完全反应,剩余4g固体为铜,由此推知20g金属混合物中含铜8g,则丙同学实验剩余的13g固体中含铁7g,故丙同学实验中硫酸已完全反应,且参加反应的铁为7g.
解答 解:(1)根据金属的活动性关系铁>氢>铜,铁能与稀硫酸反应生成硫酸亚铁同时放出氢气,而铜不能与稀硫酸反应,当把金属混合物放入足量稀硫酸中充分反应时,剩余固体为铜,而金属混合物中铁的质量为混合物质量与铜质量差.由丙可知100g硫酸能与7g铁粉反应,所以甲中只与6g铁反应,说明硫酸过量,所以反应后溶质是硫酸亚铁和硫酸化学式是:H2SO4、FeSO4;
(2)金属混合物的质量位10g,剩余固体质量为4g,则为铜的质量,则金属混合物中铜的质量分数是$\frac{4g}{10g}×100%$=40%.
(3)解:参加反应的铁的质量为:20g-13g=7g.
设生成硫酸亚铁的质量为x,生成氢气的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
7g x y
根据:$\frac{56}{152}=\frac{7g}{x}$,解得 x=19g,根据:$\frac{56}{2}=\frac{7g}{y}$,解得 y=0.25g.
所以反应后溶液质量为:20g-13g+100g-0.25g=106.75 g
反应后溶液中硫酸亚铁的质量分数为:$\frac{19g}{106.75g}$×100%≈17.8%.
答:丙同学所得溶液中硫酸亚铁的质量分数为17.8%
故答案为:
(1)H2SO4、FeSO4;(2)40%;(3)17.8%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析题意(或图表信息)等各种信息,从多组数据中筛选出对解题有帮助的数据是解这类题的关键.


 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源: 题型:选择题
 向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )
向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )| A. | 硝酸铵 | B. | 生石灰 | C. | 浓硫酸 | D. | 氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题


查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 溶液 | 各用电器工作时间/秒 | ||
| 小风扇 | 2.5V小灯泡 | 发光二极管 | |
| Xg/L H2SO4溶液 | 65 | 55 | >480 |
| Yg/L KOH溶液 | 29 | 10 | 10 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 合金中至少有一种是非金属单质 | |
| B. | 要制取2g氢气,用56g生铁与足量稀硫酸反应 | |
| C. | 将裸露的铁管埋在潮湿的土里 | |
| D. | 将锌镀在铁的表面,以保护铁不受腐蚀 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 全部 | B. | 除④外 | C. | 除⑤⑥外 | D. | ①②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
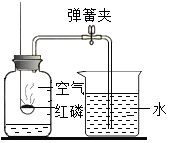
| A. | 实验时红磷一定要过量 | |
| B. | 该实验证明氧气约占空气总体积的$\frac{1}{5}$ | |
| C. | 红磷燃烧产生大量的白雾,火焰熄灭后立刻打开弹簧夹 | |
| D. | 实验前一定要检验装置的气密性 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 如图是已破损的维生素C(简写为Vc)片剂说明书的部分信息.已知维生素C由碳、氢、氧三种元素组成.请回答:
如图是已破损的维生素C(简写为Vc)片剂说明书的部分信息.已知维生素C由碳、氢、氧三种元素组成.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com