
 为测定纯碱样品中含水量(不含其它杂质),小明称取该纯碱样品5.8g,充分溶解于25g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示.请计算:
为测定纯碱样品中含水量(不含其它杂质),小明称取该纯碱样品5.8g,充分溶解于25g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示.请计算: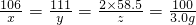 …(1分)
…(1分) ×100%=7.02%…(1分)
×100%=7.02%…(1分)

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
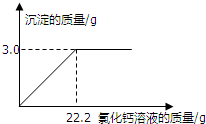 为测定纯碱样品中含水量(不含其它杂质),小明称取该纯碱样品5.8g,充分溶解于25g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示.请计算:
为测定纯碱样品中含水量(不含其它杂质),小明称取该纯碱样品5.8g,充分溶解于25g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示.请计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2011年第二十一届“天原杯”全国初中学生化学素质和实验能力竞赛(肇庆赛区)初赛试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com