
科目: 来源:山东省中考真题 题型:实验题

查看答案和解析>>
科目: 来源:山东省中考真题 题型:实验题
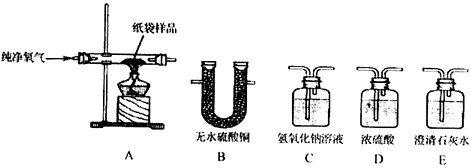
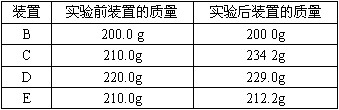
查看答案和解析>>
科目: 来源:山东省中考真题 题型:实验题

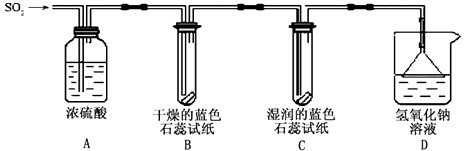
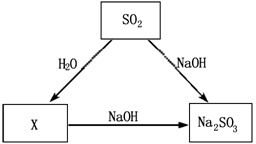
查看答案和解析>>
科目: 来源:山东省中考真题 题型:实验题
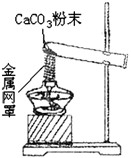
查看答案和解析>>
科目: 来源:江苏中考真题 题型:实验题
查看答案和解析>>
科目: 来源:四川省中考真题 题型:单选题
[ ]
查看答案和解析>>
科目: 来源:四川省中考真题 题型:实验题
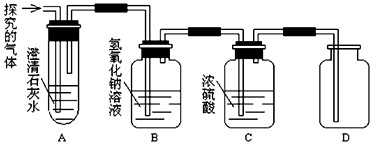
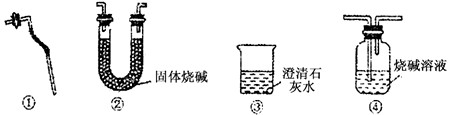
查看答案和解析>>
科目: 来源:广东省中考真题 题型:实验题


查看答案和解析>>
科目: 来源:广东省中考真题 题型:实验题

(1)装置Ⅰ是加热固体的装置,指出其中的错误_____________;要改正错误需要操作的按钮时______(填字母)。
(2)使用装置Ⅱ制取O2,化学方程式为________________。
(3)使用装置Ⅱ前要检验气密性,方法是___________________。
(4)实验室制取H2、O2、CO、CO2、NH3等五种气体,可选用装置Ⅲ来收集的气体有___________(填化学式)。
(二)某实验小组为测定铜和氧化铜混合物中氧化铜的质量分数,设计了用干燥纯净的氢气还原氧化铜的实验,所需实验装置如下图所示,回答下列问题:
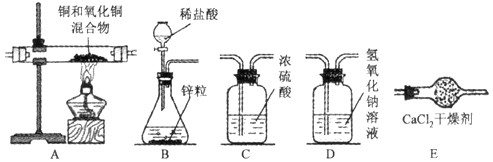
查看答案和解析>>
科目: 来源:广东省中考真题 题型:单选题
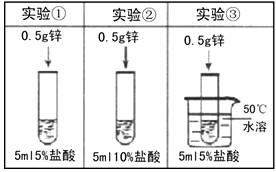
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com