
科目: 来源: 题型:
【题目】根据如图中提供的信息,请回答下列问题:

(1)由 A 图可知,硅原子核内有_____个质子,硅的相对原子质量为_____;
(2)B、C、D、E 中属于同种元素的是_____;属于金属元素的是_____。
(3)B、C 元素化学性质相似的原因是_____;
(4)C、E 两种元素组成化合物的化学式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学用语是一种信息丰富、国际通用且比较简明的化学用语,请用化学用语填空:
①2 个亚铁离子_____;
②4 个乙醇分子_____;
③ 表示的是_____;
表示的是_____;
④硝酸铵_____;
⑤地壳中含量最高的金属元素_____;
⑥氯化铜中铜显+2 价_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2在能源、材料、信息等方面有重要应用,常用作电池的正极材料和制备金属锰等物质。在化学上,还用作催化剂和氧化剂。请回答下列问题:
(1)MnO2的制备:2KMnO4+3MnSO4+2H2O===5MnO2↓+K2SO4+2H2SO4,在反应物和生成物中,锰元素的最高化合价是___________价。
(2)制备O2:加热氯酸钾和MnO2的混合物,反应的化学方程式是_________。
(3)制备Cl2:MnO2+4HCl(浓)![]() X+Cl2↑+2H2O,则X的化学式是___________。
X+Cl2↑+2H2O,则X的化学式是___________。
(4)Mn的冶炼:3MnO2+4Al![]() 3Mn+2Al2O3,基本反应类型是_________。
3Mn+2Al2O3,基本反应类型是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
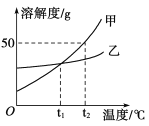
A. t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等
B. 由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C. t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90g
D. t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算:
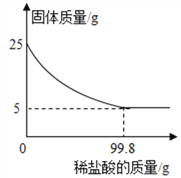
(1)这种贝壳中碳酸钙的质量分数是_______。
(2)25g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】等质量甲、乙、丙三种金属分别放入三份浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知甲、乙、丙在生成物中的化合价均为+2价)。则下列说法中错误的是( )
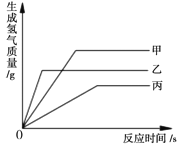
A. 生成氢气的质量:甲﹥乙﹥丙
B. 相对原子质量:乙﹥丙﹥甲
C. 金属活动性:乙﹥甲﹥丙
D. 消耗硫酸的质量:甲﹥乙﹥丙
查看答案和解析>>
科目: 来源: 题型:
【题目】下列不能达到实验目的是( )
A.  观察燃烧先后顺序,能比较两种可燃物的着火点高低
观察燃烧先后顺序,能比较两种可燃物的着火点高低
B. 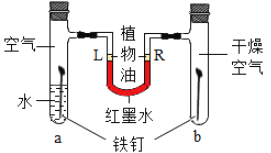 探究铁生锈条件
探究铁生锈条件
C. 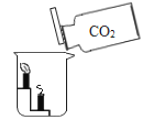 探究二氧化碳不燃烧、也不支持燃烧,密度比空气大
探究二氧化碳不燃烧、也不支持燃烧,密度比空气大
D. 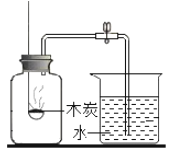 测量空气中氧气的含量
测量空气中氧气的含量
查看答案和解析>>
科目: 来源: 题型:
【题目】为减少污染、提高煤的利用率,可将其转化为可燃性气体,其微观示意图如图所示:

下列说法正确的是![]()
![]()
A. 图中表示化合物的是“![]() ”
”
B. 该反应类型为化合反应
C. 该反应中反应物两种分子的个数比为3:1
D. 反应前后原子的种类和数目保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】“黄铜”是铜锌合金,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的。现取用20.0g某种黄铜投入100g某浓度的稀盐酸中恰好完全反应,反应后生成的溶液和残余固体总质量为119.8g,请计算:
(1)生成氢气的质量_____g
(2)这种黄铜中铜的质量分数为多少?(写出计算过程)_______
(3)原稀盐酸溶质的质量分数为多少?(写出计算过程)_______
查看答案和解析>>
科目: 来源: 题型:
【题目】在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
①将pH试纸伸入某NaOH溶液中,测定NaOH溶液的pH,pH_____7(选填“大于”、“等于”或“小于”);实验操作中的错误是_____。
②将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH小于7。
结论:稀H2SO4与NaOH溶液发生了化学反应,并且_____(填写溶质的化学式)过量。
(2)方案二:向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸至过量,观察到_____的现象。
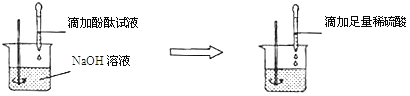
结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为_____。
(3)上述两个方案在设计思想上的相同点是_____。
(4)为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是_____(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度_____次。
(5)实验室存放的常见的碱除了氢氧化钠外,还有氢氧化钙,它们存放时都需密封保存,请用化学方程式解释澄清的石灰水必须密封保存的原因_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com