
科目: 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述错误的是
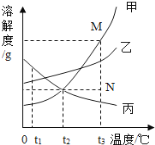
A.t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化汞受热时的变化可用下图表示(![]() 表示汞原子,
表示汞原子,![]() 表示氧原子)。据图得出的下列结论不正确的是( )
表示氧原子)。据图得出的下列结论不正确的是( )

A. 氧化汞受热时能分解成汞和氧气B. 原子是化学变化中的最小的微粒
C. 所有的物质都是由分子构成的D. 分子在化学变化中可以再分
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为____)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。
过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应热量__________(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁(Mg2(OH)2CO3)和30%的过氧化氢溶液来制取过氧化镁。
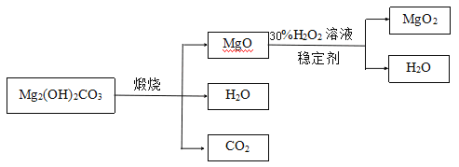
(资料)①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳②氧化镁与过氧化氢反应放出大量的热
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是________。
(4)用上述碱式碳酸镁在550、600、650及700℃下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与30%双氧水反应合成过氧化镁产率(见图1和图2)。
碱式碳酸镁煅烧的温度适宜控制在________℃,煅烧的时间适宜控制在______h。
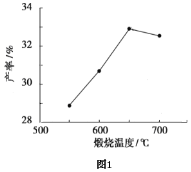
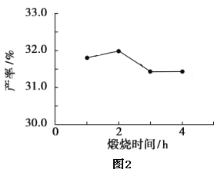
(5)结果在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因____。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。

①检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
③再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A 生成的氧气有少量溶于水 B 未等装置冷却到室温就开始读数
C 杂质与盐酸反应能产生少量的气体 D 滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是用氯化钠溶液和氯化钾溶液制取氯酸钾的工艺流程,请根据题意回答下列问题。
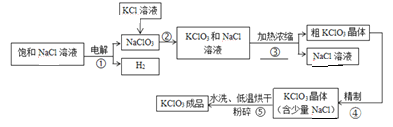
【资料】氯酸钾和氯化钠部分温度下的溶解度如下:
10℃ | 20℃ | 30℃ | 40℃ | |
氯酸钾 | 5.0g | 7.4g | 10.0g | 14.0g |
氯化钠 | 35.8g | 36.0g | 36.3g | 36.6g |
(1)请写出步骤②的化学方程式_________,该反应的基本反应类型是_________________。
(2)步骤③的操作分别是_________、过滤(填操作名称)。
(3)步骤⑤中是采用20℃以下的水进行洗涤,目的是①除去少量氯化钠②_____________。
(4)步骤⑤采用低温烘干,为什么不采用高温烘干___________________________(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取气体时常用的装置,根据装置图回答下列问题。
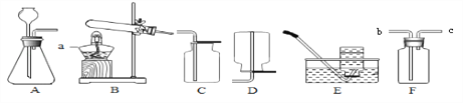
(1)仪器a的名称是__________;
(2)实验室利用锌粒和稀硫酸制取氢气所选的装置组合是__________(填序号,下同),发生反应的化学方程式为_________________;
(3)实验室利用高锰酸钾来制取氧气,发生反应的化学方程式为___________________,如果选用F装置收集氧气,则氧气从__________端通入(填“a”或者“b”)
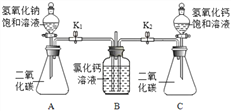
(4)实验室制取二氧化碳选择的发生装置是_________,反应的化学方程式是__________,用锥形瓶收集两瓶二氧化碳,验满的方法是________________;某活动小组利用制取的二氧化碳气体来验证氢氧化钠和氢氧化钙的性质,设计并进行以下实验(装置气密性良好):分别打开分液漏斗活塞,将等体积的氢氧化钠饱和溶液和氢氧化钙饱和溶液全部加入锥形瓶中,关闭活塞,打开弹簧夹K1、K2。A装置中看到____________________________(填实验现象)说明二氧化碳能与氢氧化钠溶液发生反应,写出A装置中发生反应的化学方程式________________________________(任写一个);能说明常温下氢氧化钠的溶解度远大于氢氧化钙的现象是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】生活中处处有化学。
(1)用正确的化学用语填空
①厨房调味品食醋中含有的酸____②制作叶脉书签的烧碱____
③用作干燥剂的氧化物生石灰____④不同的碱溶液中都含有相同的____
(2)汽车是现代生活中重要的交通工具。请回答下列问题:

①玻璃钢属于____(填“金属材料”或“复合材料”或“合成材料”)汽车电路中的导线一般为铜芯线,这是利用了金属铜的延展性和_____性。
②铝制品具有“自我保护”能力,原因是____(用化学方程式表示)。
③车用铅酸蓄电池中的酸是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】小华同学在复习酸碱盐知识时整理了如下网络图,“→”表示相互转化,“—”相互反应。已知A、B、C、D是初中化学常见的物质,为金属单质、金属氧化物、碱和盐中的各一种,下列说法不正确的是
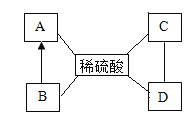
A. 如果A是铁,则A与稀硫酸反应产生气泡,溶液变成浅绿色
B. 如果B是金属氧化物,B转化为A可能是工业炼铁的原理
C. 如果C溶液呈碱性,则D只能是盐
D. 如果D与稀硫酸反应产生二氧化碳,则C只能是碱
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家用石墨烯膜制成“筛子”,可以筛掉盐类物质。当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过(如图)。下列关于石墨烯膜“筛掉”氯化钠的说法错误的是

A. 该过程属于物理变化
B. 该过程可应用于海水淡化
C. “筛掉”氯化钠过程类似于过滤操作
D. “筛掉”氯化钠后的海水溶质质量分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】苏州盛产杨梅。杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为Cl9Hl9N7O6。下列有关叶酸的说法中正确的是
A. 叶酸的相对分子质量为441 g
B. 叶酸中氮元素的质量分数大于氧元素的质量分数
C. 叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6
D. 叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成
查看答案和解析>>
科目: 来源: 题型:
【题目】“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品种领导品牌,其主要成分是过碳酸钠(2Na2CO3·3H2O2),为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂(硅酸镁不溶于水)。某化学课外兴趣小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
(查阅资料)Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2,其水溶液具有Na2CO3和H2O2的双重性质;双氧水可用于供氧、消毒和漂白
Ⅱ.过碳酸钠能与盐酸反应:2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放出的“活性氧”有关,“活性氧”含量越高,去污能力越强。
(分析推理)(1)Na2CO3中碳元素的化合价是_____。
(2)根据资料可知:过碳酸钠的用途不合理的是_____。
A 鱼池供氧剂B 消毒剂C 干燥剂D 漂白剂
(3)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中_____有硅酸镁。(填写“可能”或“一定”)
(4)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是_____。
(实验探究)过碳酸钠样品中“活性氧”含量可按如下公式计算:
“活性氧”含量=![]() ×100%
×100%
(5)为测定某过碳酸钠样品中“活性氧”含量,取20.0g样品按下图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与酸反应,装置气密性良好)
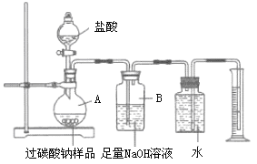
①将盐酸慢慢滴入A中,反应一段时间,观察到_____,停止滴加盐酸。
②装置B可吸收生成的CO2,该反应的化学方程式是_____。
③甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的_____。
(总结计算)(6)将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量_____,写出其计算过程。
(拓展延伸)(7)完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量。但丁同学认为该方案不合理,丁同学的理由是_____。
A 盐酸挥发出的HCl进入B装置中 B 催化剂没有让过氧化氢完全反应
C 有部分二氧化碳溶于A装置中 D 装置中还有部分残留的二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com