
科目: 来源: 题型:
【题目】向一定量CuSO4和MgSO4的混合溶液中加入铁粉和锌粉,成分反应后过滤,得到溶液A和固体B,如图所示
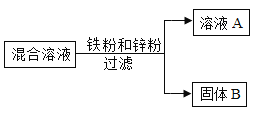
(1)若向固体B上滴加盐酸有气泡产生,则固体B一定含有哪些物质_____?
(2)若反应后所得溶液为无色,则反应后所得溶液的质量与反应前相比,是增大、减小还是不变_____?为什么?_____(用化学方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种物质的转化关系如图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。
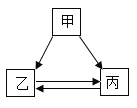
(1)若甲是一种常见的酸,乙是一种密度最小的气体,则丙的化学式可能为_____。
(2)若甲是消石灰,丙是一种白色不溶物,写出一个乙转化为丙的化学方程式。_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁、戊是初中几种常见的物质,它们分别由氢、碳、氧、氯、钠、锰中的1~3种元素组成。
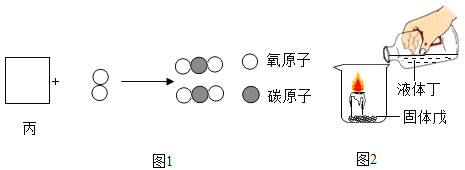
(1)乙是密度最小的气体,它在空气中燃烧的化学方程式为_____。
(2)气体丙与氧气在点燃的条件下发生反应,其微观示意图如图1,请在方框中补全相应微粒的图示_____。
(3)如图2所示,采用不同物质组合的液体丁和固体戊进行实验。
①若蜡烛的火焰熄灭,则液体丁和固体戊依次是HCl、_____。
②若蜡烛燃烧得更旺,则液体丁和固体戊混合完全反应后,烧杯中剩余的固体物质是_____。(均填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验中学同学开展复分解反应研究性学习,设计了如下研究性学习思路:
(练习质疑)下列各组物质间均能反应,写出③、④反应的化学方程式.
①氢氧化钠溶液与盐酸 ②碳酸钠溶液与硫酸
③硫酸铜溶液和氢氧化钠溶液_____.
④碳酸钠溶液和氯化钡溶液_____.
(研究讨论)上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,如①中有H+和OH﹣,②中有H+和CO32﹣,③中有_____,④中有_____.
(构建网络)按照一定的顺序排列这些离子,就可以形成一种网络形式.在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水.现有Ca2+、SO42﹣、NH4+,请将它们填入下面合适的“______、_____、_____”中,使其形成一个更为完整的复分解反应网络.
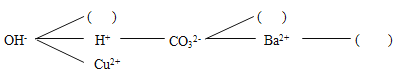
(拓展运用)通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等.如硫酸钠溶液混有硫酸铵,可以加入_____(填写化学式)除去硫酸铵.
查看答案和解析>>
科目: 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科的特点.现有A、B、C、D四种物质,其微观示意图见如表.
物 质 | A | B | C | D |
|
微观示意图 |
|
|
|
|
(1)上述物质中属于单质的是_____(填物质序号);常温下属于液体的是_____(填写化学式),日常生活中可做燃料的是_____(填物质的序号);
(2)一个C分子是由_____构成的;
(3)写出反应A+D→B+C的化学方程式:_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】现有25g的KOH和K2CO3固体混合物,已知K元素与C元素的质量比是39∶3,把该固体全部加入到盛有100g的足量稀硫酸的烧杯中,充分反应后,烧杯里残留物质的质量是120.6g,则烧杯中硫酸钾的质量为
A. 4.8g B. 9.6g C. 17.4g D. 34.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线.下列有关叙述正确的是( )
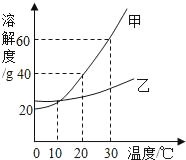
A.0℃时,甲物质的溶解度为40g
B.10℃时,甲、乙两种物质的溶解度相等
C.30℃时,甲物质饱和溶液的质量分数为60%
D.若甲物质中含有少量乙物质,可采取蒸发结晶的方法提纯甲物质
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家发现在特殊条件下水能表现出有趣的结构和性质.例如,在一定条件下给水施加弱电场,能使水在常温常压下结成冰(俗称“热冰”,结构见图).下列说法正确的是( )

A.在弱电场下,水分子的排列从无序转变为有序
B.水结成“热冰”的过程中原子个数发生变化
C.上述变化过程中分子之间的间隔没有发生变化
D.利用该性质,人们可能在常温常压下建成溜冰场
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家用石墨烯膜制成“筛子”,可以筛掉盐类物质。当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过(如图)。下列关于石墨烯膜“筛掉”氯化钠的说法错误的是

A. 该过程属于物理变化
B. 该过程可应用于海水淡化
C. “筛掉”氯化钠过程类似于过滤操作
D. “筛掉”氯化钠后的海水溶质质量分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】人类文明的发展和社会的进步同金属材料关系十分密切,其中钢铁是基本的结构材料,称为“工业的骨骼”。
(1)自行车的有些部件是由钢铁制成的。钢铁制品被腐蚀的原因,是其与_____接触引起的,为防止自行车链条生锈可采取的措施是_____。
(2)金属锂是密度最小的金属,用于原子反应堆、制轻合金及电池等。锂(Li)的原子结构示意如图1所示,它的化学性质与钠相似,原因是_____。请写出锂与稀硫酸反应的化学方程式:_____。
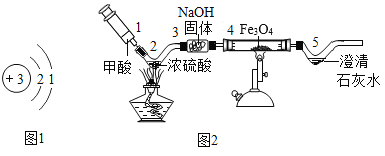
(3)同学们利用自制仪器模拟工业炼铁实验,用图2所示微型实验装置制取CO,然后用CO还原Fe3O4并检验气体产物。已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。
①位置4发生的化学方程式是_____。
②氢氧化钠固体的作用是什么?_____。
③本实验存在明显缺陷,请给出优化建议_____(写出一点即可)。
(4)工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。若用足量铝与40kg氧化铁反应,理论上可制得铁的质量是多少_____?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com