
科目: 来源: 题型:
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究。
【提出问题】①氧化铜是否也能做氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
【查阅资料】研究表明,许多金属氧化物对氯酸钾的分解有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如下表所示:
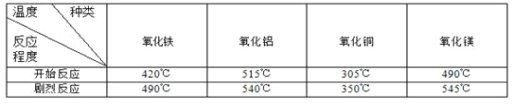
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的金属氧化物是 。
【设计并完成实验】
Ⅰ. 将3.0g氯酸钾放在试管中加热
Ⅱ. 将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ. 将3.0g氯酸钾与Xg氧化铜均匀混合加热
【实验现象分析】
Ⅲ中X的值应为 ,实验Ⅰ和Ⅲ比较可证明 。 现象与实验Ⅲ相同.实验Ⅱ和Ⅲ对比的目的是 。将实验Ⅲ反应后的固体加水溶解、 、洗涤、干燥,然后进行称量的目的是 ,最后还要再将黑色粉末和 混合加热,
【结论】氧化铜也能作氯酸钾分解的催化剂,实验Ⅲ中的化学反应的化学方程式为 。
【实验反思】MnO2的用量对 H2O2分解反应有何影响?
【设计并完成实验】利用图甲装置探究“MnO2的用量对 H2O2分解反应的影响”,实验中为3%H2O2溶液,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计。)
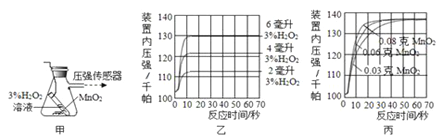
【讨论交流】(1)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出 。图丙是“不同质量的MnO2与相同体积的3%H2O2溶液混合”的实验结果,从图中可以看出 。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图回答问题:
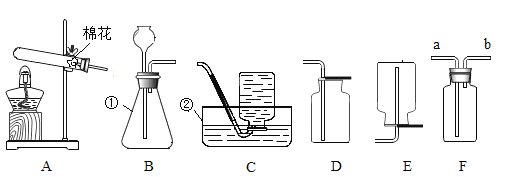
(1)写出图中标示的仪器名称:(1)________________,(2)____________。
(2)实验室用A装置制取氧气时,反应的化学方程式是___________, 可以用排水法收集氧气的原因是________。
(3)已知二氧化碳密度比空气大,能溶于水,实验室可以用块状大理石和稀盐酸在常温下反应来制取二氧化碳;则可选择的发生装置和收集装置是__________________________(填装置编号),若选择该装置用于实验室制取氧气,发生反应的化学方程式是___________________________。
(4)F装置有多种用途。若用F收集O2,证明氧气已经集满的方法是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】正确填写化学用语或其表示的含义:
①两个钾原子_______________________________;
②地壳中含量最高的金属元素和含量最高的非金属元素形成的物质_______________________________;
③标出高锰酸钾中锰元素的化合价_______________________________;
④五个硫酸根离子_______________________________;
⑤CO2中“2”的含义:_______________________________;
⑥Ca2+中“2”的含义:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某化学反应前后反应物与生成物分子及其数目变化微观示意图,其中不同的圆球代表不同的原子。下列说法正确的是
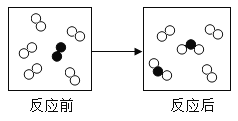
A.反应前是混合物,反应后是纯净物
B.该反应中,参加反应的两种分子个数比为5:1
C.该反应既是氧化反应,又是化合反应
D.反应前后,分子的种类与数目都发生了改变
查看答案和解析>>
科目: 来源: 题型:
【题目】空气中CO2的浓度超过正常含量将对人体健康产生危害。某化学研究小组同学对生活场景中的CO2浓度进行了如下探究。
I.探究建筑火灾中CO2浓度
如图1所示,点燃蜡烛,将CO2缓慢倒人烧杯。如图2所示模拟建筑火灾现场,在封盖容器底部放置2根高低不同的蜡烛,在烛芯附近放置O2传感器(见a1、a2)和CO2传感器(见b、b2)。点燃蜡烛后迅速封盖,采集相关数据,实验结果如图3、图4所示。
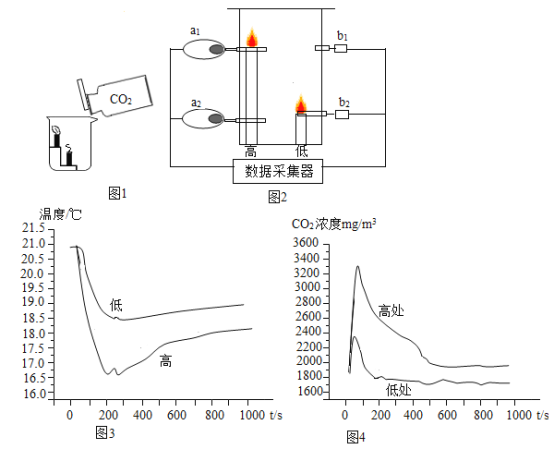
(1)图1所示实验中,观察到烧杯内低处蜡烛先熄灭,则CO2具有的性质是_______
(2)由图3可知:蜡烛熄灭时容器各处O2含量均未降至0。你对“燃烧”需要的条件的新认识是___________。
(3)在建筑火灾中,应低下身子沿墙壁或贴近地面“往低处逃生”其原因是__________。
我国部分地区有使用地窖贮存农产品的习惯,而地窖中容易积蓄CO2,根据(工作场所有害因素职业接触限值》要求,CO2短时间接触容许浓度为18mg/L。研究小组同学从某地窖中收集2瓶各500mL的气体样品进行如下实验:①将点燃的蜡烛放入瓶1中,蜡烛火焰无明显变化;②用CO2传感器测出瓶2中CO2浓度为22.6mg/L
(1)下列防范措施正确的是________(填序号)。
A 用农用喷雾器向地窖内喷酒水,使CO2溶解到水中
B 手持火把进入地窖时,若火把持续燃烧,则表示安全,继续前进
C 利用鼓风机将地窖内部分空气排出,也可打开地窖盖,通风一段时间后再进入
(2)研究小组同学向瓶2中加入足量澄清石灰水,振荡、充分反应,传感器显示CO2浓度慢慢下降,当浓度降至0.6mg/L时,计算瓶内生成沉淀的质量。(假设瓶中气体总体积不变)____________
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)方法1:将H2S在空气中点燃,不完全燃烧后生成硫和水,完成燃烧后转化为二氧化硫和水。写出H2S不完全燃烧的化学方程式:________。
(2)方法2:将H2S和空气的混合气体通入含FeCl3、FeCl2、CuCl2和HCl的混合溶液中反应,用于回收S。物质转化如下图所示:
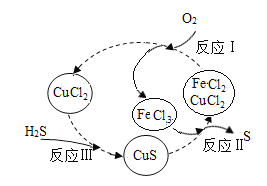
(查阅资料)反应I: 4FeCl2+O2+4HCl=4FeCl3+2H2O
反应Ⅱ: 2FeCl3+H2S=2FeCl2+S↓+2HCl
反应Ⅲ: CuCl2+H2S=CuS↓+2HCl
①将S从溶液中分离出来的操作是__________
②反应中,反应前后化合价不变的元素有___________
③实际操作时,欲使生成的硫单质中不含CuS,应提高混合气中空气的比例,其原因是__________
④该工艺中可循环使用的物质是FeCl3、FeCl2和_________(填化学式)。
(3)方法3:H2S气体在高温下会反应生成S2和H2。该反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用下图装置制取常见气体。
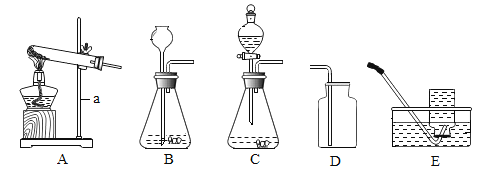
(1)仪器a的名称是__________
(2)实验室用KMnO4制取较纯净的O2,反应的化学方程式为_______;用装置A制取O2时应作的改进是____________,选用的收集装置是_______(填序号)。
(3)用H2O2溶液和MnO2制氧气时,与装置B相比,选用装置C的优点是_______
(4)某兴趣小组同学对氢气性质实验进行了如下改进。
①如图中利用锌与稀硫酸反应制取氢气的化学方程式为__________。在U型管ロ点燃氢气,发出尖锐爆鸣声;3-5秒后再次点燃,氢气安静地燃烧。U型管中水的主要作用是_______。
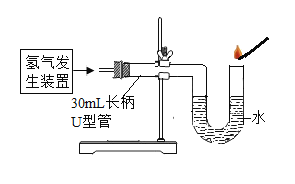
②缓慢连续推动图5中的注射器活塞,注入30mL氢气时,点燃酒精灯;一段时间后,U型管底观察到的现象为__________,发生反应的化学方程式为________。
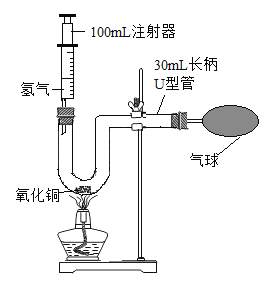
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年12月8日,搭载“嫦娥四号”的“长征三号乙”运载火箭发射成功。
(1)火箭可用液氢和液氧作推进剂。液氧属于__________(填“纯净物"或“混合物”),工业上大量制取氧气的方法是___________。
(2)火箭也可用C2H8N2和N2O4,作推进剂,发生反应的化学方程式为:C2H8N2+2N2O4=3N2+4H2O+2X。N2O4中氮元素的化合价为________,x的化学式为________。
(3)“嫦娥四号”光伏发电板中含有硅。单质硅可由石英(SiO2)固体和焦炭在高温下反应制得,同时产生一种可燃性气体,该反应的化学方程式为______________。
(4)“长征三号乙”运载火箭发动机在焊接时需使用氩弧焊。焊接时用氩气作保护气的原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() ,CaCO3
,CaCO3![]() CaO+CO2↑。取12.9gMg(OH)2和CaCO3的混合物,加热,剩余固体质量随时间变化如图所示。
CaO+CO2↑。取12.9gMg(OH)2和CaCO3的混合物,加热,剩余固体质量随时间变化如图所示。
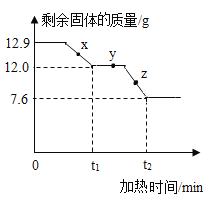
下列说法错误的是
A.x点剩余固体成分为CaCO3、MgO和Mg(OH)2
B.y点剩余固体中镁元素质量为1.2g
C.z点发生的反应为CaCO3![]() CaO+CO2↑
CaO+CO2↑
D.若剩余固体中钙元素的质量分数为36.0%,则剩余固体的成分为CaCO3和MgO
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下密闭容器内发生某反应,反应过程中各物质的质量变化见下表。
物质 | 甲 | 乙 | 丙 | 丁 |
反应前 | 46g | 100g | 2g | 0 |
反应中 | 23g | 52g | 46g | m1 |
反应后 | m2 | 4g | m3 | m4 |
其中未知数据错误的是
A.m1为29gB.m2为0gC.m3为90gD.m4为54g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com