
科目: 来源: 题型:
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
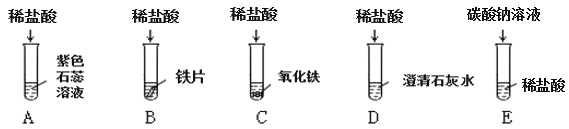
(1)上述反应中无明显现象的为_______________(填字母序号,下同),有气泡产生的是____________;B 试管中所发生反应的化学方程式为____________。
(2)将反应后 D 和 E 试管中的废液倒入一洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行 探究。
查阅资料得知:CaCl2+Na2CO3=2NaCl+CaCO3↓;Na2CO3+2HCl=2NaCl+H2O+CO2![]() 。
。
(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl;猜想二:NaCl 和 CaCl2 ;猜想三:NaCl、Ca(OH)2 和 HCl;猜想四:____________。
(讨论与交流)经讨论,同学们一致认为猜想____________是错误的。
(实验与结论)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四 成立 |
取少量滤液于试管中,滴加适量_____________ | ____________ |
(拓展与迁移)稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中和反应是一类重要的化学反应。某同学利用图 1 装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH 和温度传感器测量反应过程中相关物理量的变化情况,得到图 2 和图 3。
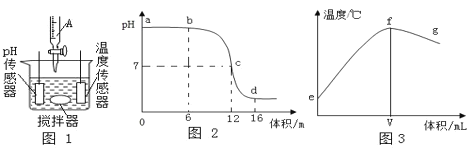
(1)烧杯中发生反应的化学方程式为____________。
(2)仪器 A 中溶液的溶质是____________(填化学式)。
(3)图 3 中 V 的数值最接近图 2 中的____________(填图 2 中横坐标中的数值,“6”、“12” 或“16”)。
(4)下列说法正确的是____________(填序号)。
A图 2 中 b 点所示溶液中的溶质是 NaCl 和 NaOH
B取图 2 中 d 点所示溶液加热蒸干所得固体为纯净物
C图 2 中 c→d 所示溶液中 NaCl 质量不断增加
D图 3 中 e→f 变化趋势说明该反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含 Y2O3 约 70%,含 Fe2O3、CuO、SiO2 等约30%)生产大颗粒氧化钇的种工艺如下:
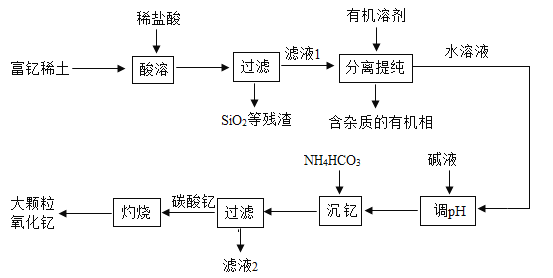
(1)氧化钇(Y2O3)中,Y 元素的化合价为____________。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是____________。
(3)“分离提纯”是为了除去滤液 1 中的___________(填化学式)。
(4)“调 pH”时加入碱液使溶液的 pH____________(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究物质的溶解对于生产、生活有着重要意义。A、B 两种物质的溶解度曲线如图 1 所示;20℃时,将 A、B 两种固体各 50g,分别加入到盛有 100g 水的烧杯中,充分搅拌后现象如图 2 所示;升温到 50℃时,A、B 两种固体在水中的溶解情况如图 3 所示。请回答下列问题
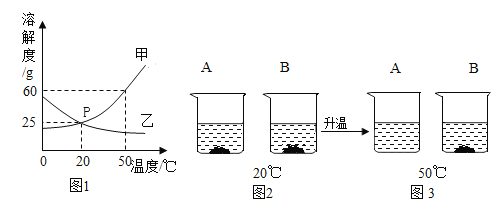
(1)图 1 中 P 点的含义____________。
(2)图 1 中能表示 A 物质溶解度随温度变化的曲线是____________(填甲或乙)。
(3)从 20℃到 50℃的变化过程中,一直处于饱和状态的是____________(填 A 或 B)溶液。
(4)50℃时向盛有 40g 物质甲固体的烧杯中加入50g水充分溶解后,所得溶液溶质的质量分数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属在生产、生活中有广泛应用。
(1)我国深水钻井平台“981”用钢量达3万吨,露出平台的钢很容易生锈,铁锈的主要成分是____________(填化学式),写出用盐酸除去铁制品表面铁锈的化学方程式____________。
(2)现有含杂质的赤铁矿(主要成分为 Fe2O3)样品,为了测定该样品中氧化铁的质量分数,某同学取该样品 5.0g。该同学在实验室用一氧化碳还原赤铁矿(杂质不参加反应)。装置示意图如下:
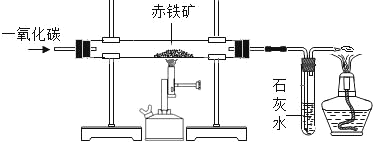
①在直形管内发生反应的化学方程式是:____________。
②下列关于该实验的操作描述正确的是_________________。
A开始时应先预热玻璃管,后通入一氧化碳
B反应过程可观察到固体由黑色逐渐变红
C盛装药品前应先检查装置气密性
D将尾气点燃或收集,可防止一氧化碳污染空气
③样品充分反应后,测定实验数据,澄清石灰水增重 3.3g.计算:
I.反应生成 CO2 的质量是____________;
II.该样品中氧化铁的质量分数是____________。
(3)某化学兴趣小组同学在实验室将一定质量的锌粉放入盛有硝酸银、硝酸铜和硝酸镁的混合溶液中,充分反应后过滤,得到滤渣和滤液,滤液呈无色。
①滤渣中一定含有的金属是____________。
②滤液中一定含有的阳离子是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科学习的特点。
(1)甲、乙、丙、丁表示四种物质,它们的微观示意图如表所示:
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
|
①一个丙分子共有___________个原子。
②甲、乙、丙、丁四种物质中属于氧化物的是__________和____________(写化学式)。
(2)工业上使用一种国产低温催化剂生产氢气的反应过程如图所示:
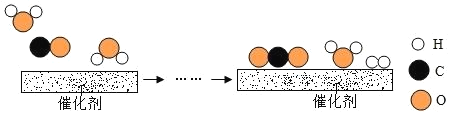
①该反应的化学方程式为_______________;
②参加反应的![]() 与
与![]() 分子个数之比为______________。
分子个数之比为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请结合下列实验装置,回答有关问题。

(1)写出图中仪器a的名称:①_____。
(2)实验室用加热高锰酸钾制取并收集氧气,应选择的装置为②_____(填字母,下同),发生反应的化学方程式为③_____。
(3)实验室用石灰石与稀盐酸反应制取二氧化碳,应选择的发生装置为④_____。
有学生对此反应后的溶液感兴趣,他取适量反应后过滤的滤液,逐滴滴入碳酸钠溶液(碳酸钠溶液显碱性),并用pH传感器连续监测,得到如图曲线图(纵坐标为pH,横坐标为时间)
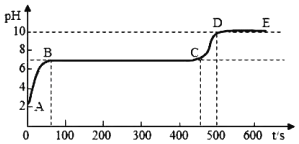
I.请分析图,写出AB段内发生的化学反应方程式⑤_____。
Ⅱ.图中CD段上升的原因你认为是⑥_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。
(1)亚氯酸钠(NaClO2)在酸性溶液中生成HClO2而发生分解,分解的化学方程式:5HClO2═4X↑+HCl+2H2O。HClO2读作____,其中氯元素的化合价为___;X的化学式___。
(2)以氯酸钠(NaClO3)等为原料可以制备亚氯酸钠。氯酸钠受热会分解,其生成物与氯酸钾分解的生成物相似。除此以外,氯酸钠与氯酸钾还具有一些其它相似的化学性质。
①试写出氯酸钠受热分解的化学方程式___。
②试分析氯酸钠与氯酸钾具有相似化学性质的原因___。(填字母)
A 都含氯元素 B 都含氧元素 C 都含ClO3- D 以上都是
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A. 碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3)g
B. 碳酸乙烯酯中C、H、O三种元素的质量比为12:1:16
C. 碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
D. 碳酸乙烯酯中碳元素的质量分数= ![]() ×100%
×100%
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钠和硝酸钾两种固体的溶解度曲线如右图所示。下列说法正确的是
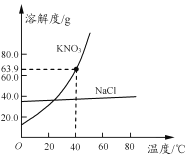
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0%
D.将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com