
科目: 来源: 题型:
【题目】下列对客观事实书写的化学方程式及其反应类型都正确的是( )
选项 | 客观事实 | 化学方程式 | 基本反应类型 |
A | 铁丝在氧气中燃烧 | 2Fe+3O2 | 化合反应 |
B | 加热高锰酸钾 | 2KMnO4 | 分解反应 |
C | 乙醇燃烧 | C2H5OH+3O2 | 氧化反应 |
D | 硫酸钾溶液和氯化钡溶液反应 | K2SO4+BaCl2=2KCl +BaSO4 | 复分解反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图提供的信息,下列说法不正确的是 ( )
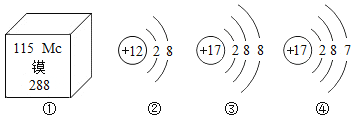
A.①的原子中的质子数是115
B.③④属于同种元素
C.②③都属于阴离子
D.②③按 1∶2 个数比构成物质
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用下图所示装置测定空气里氧气的含量,实验时,连接好装置并检查不漏气后再进行后续操作,下列说法正确的是( )
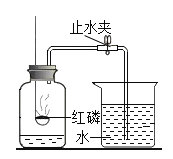
A. 所用红磷要过量,以保证集气瓶内空气里的氧气能充分反应
B. 在空气里点燃红磷后,应缓慢把燃烧匙伸入瓶内并塞紧橡皮塞
C. 红磷燃烧时,要打开止水夹,以免瓶因温度升高,气压较大,造成橡皮塞从瓶口脱落
D. 仍用本装置,只把红磷换成燃烧的本炭,能够更精确测定空气里氧气的含量
查看答案和解析>>
科目: 来源: 题型:
【题目】工业盐酸中通常含少量 FeC13 而呈黄色,小亮为测定某工业盐酸中 HCl 的含量进行如下实验, 取某工业盐酸80g,滴加溶质质量分数为 20%的 NaOH 溶液,反应过程中,当加入的 NaOH 溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表,请根据表格和图象完成下列问题:
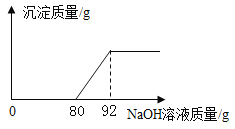
加入NaOH 溶液的质量/g | 25 | 50 | 75 | 100 |
所得溶液的质量/g | 105 | 130 | 155 | m |
(1)开始没有产生沉淀的原因是_____________。
(2)求该工业盐酸中 HCl 的质量分数__________(写出计算过程)。
(3)表格中 m 的值为_____________(结果保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙(CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为 Ca(OH)2,含少量 CaCO3] 为原料制备 CaO2 的一种工艺流程如图甲所示:
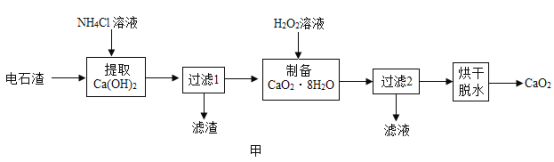
(查阅资料)Ⅰ.Ca(OH)2+2NH4Cl=CaCl2+2NH3H2O
Ⅱ.CaCl2+2NH3H2O+H2O2+6H2O=CaO28H2O↓+2NH4Cl
Ⅲ.CaO28H2O在水中不太稳定,会缓慢分解
(1)CaO2 与 CO2 反应除了生成氧气外、还生成一种常见的盐,写出反应的化学方程式___________。
(2)“提取 Ca(OH)2”时反应的基本类型是__________________;Ca(OH)2 的俗名为___________________;“过滤 1”所得滤渣的主要成分是______________。
(3)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“一贴”指的是滤纸紧贴漏斗壁, 原因是_______________________。实验室粗略测定溶液的酸碱度,常使用(填名称)_________________。
(4)在其他条件不变的情况下,制备 CaO2·8H2O 的反应时间(t)对其产率(ω )的影响如图乙所示。
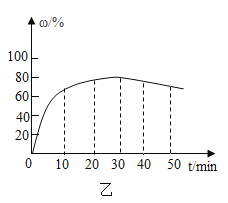
①平均反应速率最快的时间段为___________。
②30min 后,ω 开始下降的主要原因是_________________。
(5)为了测定加入的 NH4Cl 溶液中溶质的质量分数,取 107.0gNH4Cl 溶液于烧杯中,加入稍过量的 AgNO3 溶液,完全反应后过滤、洗涤、干燥、称量, 得到14.35 g 白色固体。通过计算确定该溶液中NH4Cl 的质量分数为________。(精确到 0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图所示装置图,回答有关问题:
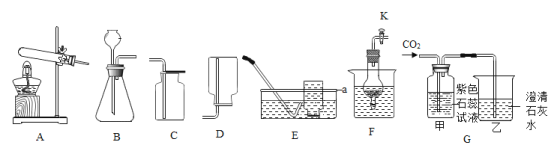
(1)写出装置图中标号仪器的名称:a_________。
(2) 实验室用高锰酸钾制取氧气,其发生装置可选择__________(填字母),反应的化学方程式为________。可用 E 装置收集氧气的原因是_____________。
(3)实验室通常用 A-E 中的装置_____________(填字母)相连制取二氧化碳。如果用图 F 所示装置来制二氧化碳,其优点是_____________________。
(4)用纯净的二氧化碳气体按图 G 装置进行实验。观察到的主要现象是:甲中_____________________、乙中澄清石灰水变浑浊。乙中发生反应的化学方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
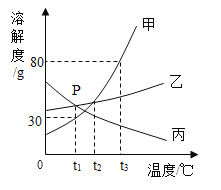
(1)P 点表示的含义是______________。
(2)当甲中含有少量乙时,提纯甲的方法是___________________。
(3)要使接近饱和的丙溶液变为饱和溶液,可采取的措施有(任写一种)_______________。
(4)t1℃时,将 30g 甲物质投入到 50g 水中充分溶解后,所得溶液的质量为_________g;若将温度升至 t3 ℃,使所得溶液的溶质质量分数变为 20%,应该再加水___________g。
(5)t3 ℃时,取等质量的甲、乙、丙三种物质分别配制成饱和溶液,需要水的质量最小的是_________。
(6)t3 ℃时,将等质量的三种物质的饱和溶液降温到 t2℃,对所得溶液的叙述正确的是_______________(填字母)。
A 溶液的质量关系是丙>乙>甲
B 丙溶液的溶质质量分数不变
C 溶剂的质量关系是甲=乙>丙
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活密切相关,请用所学知识回答下列问题:
(1)石油是人类重要的能源。
①石油分馏得到的产品中,常用作汽车燃料的是___________(答一种物质即可)。
②汽车尾气中含有许多有害气体,使用催化转换器可减少有害气体的排放,其中某一反应过程的微观变化如图所示。请你写出该反应的化学方程式:_____________________;安装催化转换器虽然能减少有害气体 的排放,但不能减少二氧化碳的排放,仍会导致的另一个环境问题是______________________;为控制空气中二氧化碳 的含量,以下建议可行的是___________________(填字母)。
A 发展公共交通 B 开发新能源 C 禁止使用化石燃料 D 大力植树造林

(2)材料是时代进步的重要标志,有机合成材料的出现更是材料发展史上的一次重大突破。请回答:
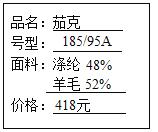
①由合成纤维与天然纤维混合纺织的面料,使衣服穿起来既舒适又不易褶皱,如图是某品牌服装标签上的部分内容,其中利用了合成纤维的_____________(填字母,下同)等优良性能。
A 弹性好 B 耐磨 C 吸水性强 D 透气性好
②生活中常用__________的方法鉴别合成纤维和天然纤维。
③为了解决白色污染问题,禁止超市无偿提供塑料购物袋, 该举措的意义是_____(填字母)。
A 倡导重复使用塑料袋 B 节约资源
C 保护生态环境 D 增加超市的利润
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com