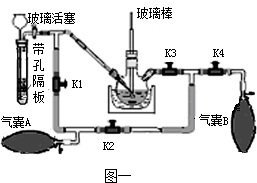
26、某化学兴趣小组用下图所示装置(省略了夹持装置)做如下实验:

研究课题:探究食品保鲜袋的元素组成.
查阅资料:碱石灰是由氢氧化钠和氧化钙组成的吸收剂;无水硫酸铜可作为吸水剂,且吸水后显蓝色.
提出猜想:制保鲜袋的材料可能是由“碳、氢、氧”中两种或三种元素组成.
实验步骤:
①按图示连接好仪器,将止水夹夹在F后的橡胶管处,B中注入适量水,当向A中缓缓注入少量水时,观察到装置B中的现象为X
G处液柱上升
,说明装置的气密性良好.
②按图示装好药品和1.4g剪碎的保鲜袋样品,除D、E、F、止水夹外将仪器按原样组装.
③向A中缓慢注水一段时间后,将已称重的D、E两干燥管和未称重F干燥管接到C的尾端.④给装置C加热,直至保鲜袋碎片完全燃烧.
⑤停止加热并继续向A中注水一段时间.
⑥分别对D、E进行第二次称重.
实验分析:
(1)根据实验原理分析,该套装置中缺少的玻璃仪器是
酒精灯
.
(2)实验步骤①中,观察到的现象为
G处液柱上升
.
(3)设置F处的干燥管的目的是
防止装置外空气中的CO2和H2O被E吸收,影响实验
.B处的浓硫酸起的作用是
干燥氧气或除去水蒸气
,如果没有B则对实验结果的影响是
使氢元素质量偏大或使水的质量偏大
.
(4)在加热装置C前,要向A中缓慢注水一段时间是为了
将装置中的空气排尽
.停止加热后继续向A中缓慢注水一段时间是为了
将生成的二氧化碳和水驱赶至D、E装置中被完全吸收
.
(5)第一次对D、E称重质量分别为82.0g、85.0g;第二次对D、E称重质量分别为83.8g、89.4g;则样品完全燃烧后产生水的质量为
1.8
g.
实验结论:
(6)该样品的组成元素一定是
C、H
.