
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 2KNO2+O2↑
2KNO2+O2↑ 2CuO+4NO2↑+O2↑,2AgNO3
2CuO+4NO2↑+O2↑,2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑ M(NO2)2+O2↑
M(NO2)2+O2↑ 2MO+4NO2↑+O2↑
2MO+4NO2↑+O2↑
 2Fe2O3+8NO2↑+O2↑,现在对KNO3、Cu(NO3)2、Fe(NO3)2 的混合粉末充分加热后未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是 ( )
2Fe2O3+8NO2↑+O2↑,现在对KNO3、Cu(NO3)2、Fe(NO3)2 的混合粉末充分加热后未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是 ( )查看答案和解析>>
科目: 来源: 题型:阅读理解
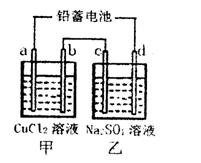
 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 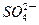 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
 H++A2-,请回答下列问题:
H++A2-,请回答下列问题: CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1 CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1 CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。查看答案和解析>>
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:


 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ; ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1  ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1查看答案和解析>>
科目: 来源: 题型:
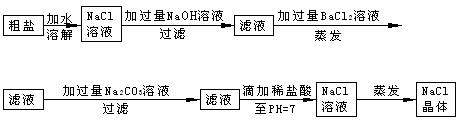
查看答案和解析>>
科目: 来源: 题型:
| 物质 | 加入试剂 | 离子方程式 |
| KCl(K2CO3) | .Com] | |
| FeCl3(FeCl2)溶液科 | [网] | |
| FeSO4 (CuSO4) 溶液 | | |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com