
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,Y、Z、W原子的最外层电子数之和为14,含有Y元素的阴离子和阳离子在溶液中能反应生成沉淀,Z原子的最外层电子数是内层电子数的![]() ,X的简单氢化物分子式为XH4。下列说法正确的是
,X的简单氢化物分子式为XH4。下列说法正确的是
A.X、Z能形成共价化合物
B.W的阴离子半径大于硫离子半径
C.含有W元素的酸都有漂白性
D.室温下,含Y元素的阳离子与任何碱反应都可转化为含有Y元素的阴离子
【答案】A
【解析】短周期元素中,含有Y元素的阴离子和阳离子在溶液中能反应生成沉淀,则阳离子为Al3+,阴离子为![]() ,沉淀为Al(OH)3,可知Y是Al元素,Z原子的最外层电子数是内层电子数的
,沉淀为Al(OH)3,可知Y是Al元素,Z原子的最外层电子数是内层电子数的![]() ,Z是Si元素,X的简单氢化物分子式为XH4,可知X为C元素,Y、Z、W原子的最外层电子数之和为14,可得W原子最外层有7个电子,W为Cl元素。A项,C、Si可形成共价化合物SiC,正确。B项,Cl与S2具有相同的电子层结构,原子序数越小,离子半径越大,所以Cl的离子半径小于S2的离子半径,错误。C项,盐酸(HCl溶液)无漂白性,错误。D项,Y是铝元素,Al3+与过量强碱反应可生成
,Z是Si元素,X的简单氢化物分子式为XH4,可知X为C元素,Y、Z、W原子的最外层电子数之和为14,可得W原子最外层有7个电子,W为Cl元素。A项,C、Si可形成共价化合物SiC,正确。B项,Cl与S2具有相同的电子层结构,原子序数越小,离子半径越大,所以Cl的离子半径小于S2的离子半径,错误。C项,盐酸(HCl溶液)无漂白性,错误。D项,Y是铝元素,Al3+与过量强碱反应可生成![]() ,但与NH3·H2O反应不能生成
,但与NH3·H2O反应不能生成![]() ,D项正确。
,D项正确。


科目:高中地理 来源: 题型:
【题目】将淀粉水解,并用新制的氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是①加热;②滴入稀硫酸;③加入新制的氢氧化铜悬浊液;④加入足量的氢氧化钠溶液。以上各步操作的先后顺序排列正确的是( )
A.①②③④① B.②①④③①
C.②④①③① D.③④①②①
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】从同一高度落下的玻璃杯掉在水泥地上比掉在泥土上易碎,是因为掉在水泥地上时,杯子
A.动量大 B.动量的变化量大
C.受到的作用力大 D.受到的冲量大
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。下列叙述错误的是( )
A.硅单质可用来制造太阳能电池
B.氮化硅陶瓷属于新型无机非金属材料
C.为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
D.高温下,二氧化硅能分别与C、CaCO3、Na2CO3发生反应
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为2011年以来世界部分国家和地区二氧化碳排放量变化示意图。读图回答下列各题。
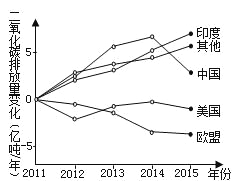
【1】下列叙述正确的是
A. 印度是2015年二氧化碳排放量最多的国家
B. 欧盟国家二氧化碳排放量呈减少趋势
C. 中国二氧化碳排放量逐年减少
D. 各国对二氧化碳减排负有共同但有区别的责任
【2】人类大量排放二氧化碳对地理环境的影响可信的是
A. 北美洲暴雪天气增多
B. 印度洋珊瑚大量死亡
C. 昆仑山雪线逐年降低
D. 内蒙古牧场面积扩大
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为亚洲五个人口大国(3000万以上)近50年城市化水平变化图。读图回答下列问题。

【1】近50年,甲国城市化发展速度的变化趋势为
A.先快后慢再快 B.先慢后快再慢 C.先快后慢 D.先慢后快
【2】形成甲国与其他四国城市化差异的主要原因是
A.地理区位的差异 B.文化传统的差异
C.经济水平的差异 D.人口总数的差异
【3】 由图中信息可直接推出的结论是
A.近50年,甲国城市人口数一直最多
B.近50年,甲国的经济发展速度一直最快
C.近50年,五国城市化水平皆在不断提高
D.1980年以来,乙丙丁戊四国城市化水平大幅度提高
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】阅读图文材料,回答下列问题。
咖啡树属茜草科,产于热带、亚热带的常绿小乔木或灌木。主要分
布在南北回归线之间的地区,原产于非洲埃塞俄比亚南部的高原地区。下图为埃塞俄比亚简图,甲城市以咖啡贸易著称,主要出口欧洲,被称为“咖啡城”。
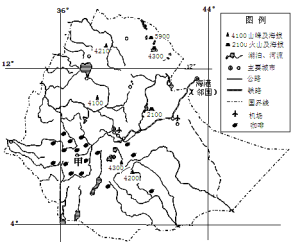
(1)简述该国咖啡原产地适宜种植咖啡的自然条件。
(2)评价甲城市发展咖啡贸易的条件。
(3)有人认为甲城市周边广大地区应该扩大咖啡的生产规模。你是否赞成,并说明理由。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是:_________________________________。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O,他们利用该反应设计如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O,他们利用该反应设计如下制取氯气并验证其性质的实验。
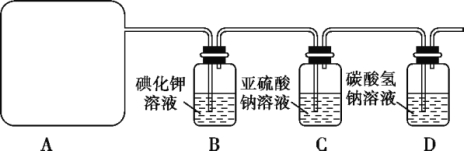
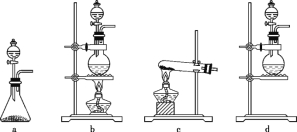
回答下列问题:
(1)该实验中A部分的装置是 (填标号)。
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):______________________ ________
(3)写出D装置中发生反应式: 。
(4)该实验存在明显的缺陷,请你提出改进法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置,待完全反应后,用0.1 mol·L-1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为2Na2S2O3+I2![]() Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为 。
Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com