
【题目】用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液中溶质的物质的量浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出
B.样品中含有少量Na2O杂质(已知Na2O+H2O===2NaOH)
C.容量瓶使用前未干燥
D.定容时仰视容量瓶刻度线
 阅读快车系列答案
阅读快车系列答案科目:高中地理 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_____________________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象___________。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是___________。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】在铁制品上镀上一层锌层,以下电镀方案中合理的是( )
A.锌作阳极,铁制品作阴极,溶液中含Fe2+
B.锌作阴极,铁制品作阳极,溶液中含Zn2+
C.锌作阴极,铁制品作阳极,溶液中含Fe3+
D.锌作阳极,铁制品作阴极,溶液中含Zn2+
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Syrian state media says a bomb has exploded at the state talevision building in Damascus(大马士革),___several people
A.wounding
B.having wounded
C.to wound
D.to have wounded
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】水量盈余率是衡量水库蓄水量变化的重要指标(水量盈余率=流入量/流出量),图为某区域略图,表为图示水库各月水量盈余率统计表。据此回答下列各题。
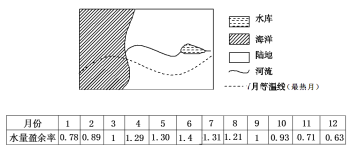
【1】根据图表信息判断,该地区位置及气候是( )
A.南半球、地中海气候
B.北半球、热带草原气候
C.南半球、热带草原气候
D.北半球、地中海气候
【2】关于图示水库的说法正确的是( )
A.12月份水库的储水量最大
B.3月份水库的储水量最大
C.6月份水库的储水量最小
D.9月份水库的储水量最大
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO![]() 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。
丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是______________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(OH-)
)+c(OH-)
c.HCO![]() 的电离程度大于HCO
的电离程度大于HCO![]() 的水解程度
的水解程度
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】The monitor___the examination papers to the students
A.collected
B.distributed
C.reported
D.presented
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】(双选)下列物质分类合理的是( )
A.根据物质组成中是否含有碳元素,将物质分为无机物和有机物
B.HCOOCH3、CH3OCHO--互为同分异构体
C.HCOOH、C15H31COOH--互为同系物
D.天然油脂的分子中含有酯基,属于酯类
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】甲乙两同学分別对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置己略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4
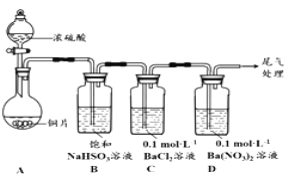
①A中反应的化学方程式是______________________。
②为探究SO2在D中所发生反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价硫元素的物质性质进行探究。
序号 | 实验操作 | 实验现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大重白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:____________________。
②由实验1、2、3对比,可以得到推论:____________________。
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取_______固体混合物,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii实验1和4对比,乙获得推论:_____________________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加_________(填字母序号)
a. 2mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
b. 2mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
c. 2mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
d. 2mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com