
【题目】下列说法中正确的有 ( )
A.导体中电荷运动就形成了电流
B.电流强度的单位是安培
C.电流强度有方向,它是一个矢量
D.一切导体,只要其两端电势差为零,则电流强度就为零
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中地理 来源: 题型:
【题目】关于摩擦起电和感应起电,以下说法正确的是
A.摩擦起电是因为电荷的转移,感应起电是因为产生电荷
B.摩擦起电是因为产生电荷,感应起电是因为电荷的转移
C.不论摩擦起电还是感应起电都是电荷的转移
D.以上说法均不正确
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】为打击索马里海盗,吉布提港逐渐成为各国军舰后勤物资补给基地。2014年8月,中国企业中标吉布提港口码头建设,一旦多功能码头建成,吉布提将成为区域航运和物流中心。下图为世界局部地区示意图。据此完成下面小题。
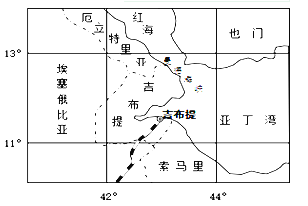
【1】一艘军舰从吉布提港出发,以时速22节(1节=1.852千米)航行,10小时后,该军舰可能位于
A. 16°N B. 7°N C. 10°N D. 55°E
【2】吉布提港建设中遇到的主要困难是
A. 气候湿热,易发生中暑 B. 河湖密布,投资成本大
C. 人口稠密,地价水平高 D. 地质复杂,技术要求高
【3】未来吉布提港将成为
A. 北非国家的出海口 B. 红海及周边中转站
C. 非洲最大物流中心 D. 中东地区航运中心
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:3SiH4+4NH3![]() Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si![]() 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)

①NH4Cl中的化学键类型有______________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是______________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式_______________________,实验室可利用如图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。

(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_________________________。
将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】You are working too hard.You’d better keep a___between work and relaxation
A.promise
B.lead
C.balance
D.diary
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下列说法中错误的是( )
A.在豆浆中加入少量的石膏,能使豆浆凝结为豆腐
B.温度越高,酶的催化活性越强
C.用灼烧的方法可以鉴别毛织物和棉织物
D.浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了显色反应
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为印度半岛局部地区等高线地形图及该地气候资料图,据图表回答下列问题。
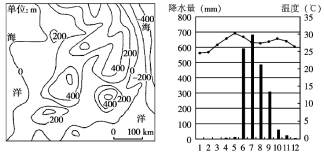
(1)判断该地的主要粮食作物种类并说明理由。
(2)判断该地粮食作物主要分布的区域,并说明原因。
(3)指出该地气候给农业生产带来的不利影响,简述原因并提出应对措施。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】2002年12月31日上午,举世瞩目的上海磁悬浮列车线首次试运行,它是世界上第一条投入商业运营的磁悬浮列车线.运行全程共30km,最高时速可达552km,单向运行约8min.磁悬浮列车上装有电磁体,铁路底部则安装线圈.通过地面线圈与列车上的电磁体排斥力使列车悬浮起来.地面线圈上的极性与列车上的电磁体下极性总保持 ( )
A.相同 B.相反
C.不能确定 D.以上均不对
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】某化学课外兴趣小组用下图所示装置探究铜跟浓硫酸的反应情况。
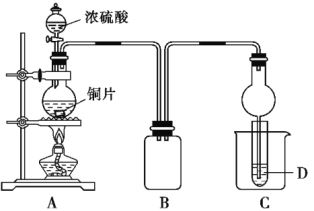
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4 g 铜片和12 mL 18 mol·![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式: ;
②有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是 (填写编号,仅有一个正确)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你从不可行的方案中选出一例进行分析:
[要求标明不可行的方案序号,说出不可行的理由及造成的误差(偏高或偏低)]。
(4)请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com