
【题目】下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4二氯甲苯
科目:高中地理 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为 ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使高锰酸钾酸性溶液褪色
D. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】读下图,回答问题:
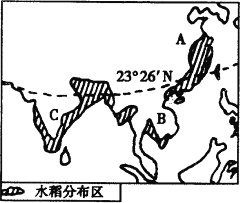
(1)据图写出水稻主要分布区______________________________________________;
(2)A、B、C三地均为_______气候区,水热资源丰富,从地形上看,水稻田多分布在____________________地区。
(3)写出水稻种植业主要分布区的社会经济条件____________________________
________________________________________________________________________;
(4)亚洲水稻生产单产量高但商品率低的原因主要是__________________________;
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图是中心地市场区域图,回答下列问题。
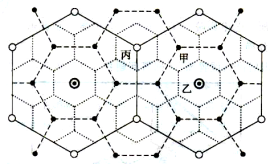
【1】关于中心地等级的比较,正确的是
A.甲>乙<丙 B.乙>丙>甲
C.甲<乙<丙 D.甲<丙>乙
【2】下列商业部门与图中中心地对应正确的是
A.甲为普通饭店、乙为小吃店、丙为五星级酒店
B.甲为小吃店、乙为普通饭店、丙为五星级酒店
C.甲为小吃店、乙为五星级酒店、丙为普通饭店
D.甲为五星级酒店、乙为小吃店、丙为普通饭店
【3】下列关于城市等级与服务范围大小关系的说法,正确的是
A.城市等级越低,数目越多,服务范围越小
B.城市等级越高,数目越多,服务范围越大
C.城市等级越高,数目越少,服务范围越小
D.城市等级越低,数目越少,服务范围越大
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】Bicycling is good exercise;___,it does not pollute the air
A.nevertheless
B.besides
C.otherwise
D.therefore
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】缩醛在有机合成中常用于保护羰基或作为合成中间体,同时还是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。下面是G的一种合成路线:
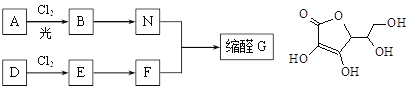
已知:
① 芳香烃A含氢元素的质量分数为8.7%,A的质谱图中,分子离子峰对应的最大质荷比为92;D的产量可以用来衡量一个国家的石油化工发展水平。
② 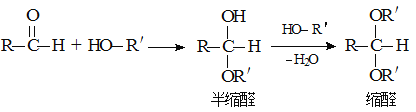
③ 同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的结构简式是 ,E的名称是 。
(2)由D生成E的反应类型是 ,E→F的反应条件是 。
(3)由B生成N的化学方程式为 。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉、效率高、污染物少的优点。维生素C的结构如右图。则维生素C分子中含氧官能团名称为 。
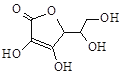
(5)缩醛G的结构简式为 。G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式: 。
①既能发生银镜反应,又能与FeCl3发生显色反应;②核磁共振氢谱为4组峰。
(6)写出用2-丁烯为原料(其他无机试剂任选)制备顺丁橡胶(顺式聚1, 3-丁二烯)的合成路线: 。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】读“我国某城市城市化发展阶段示意图”回答下列问题。
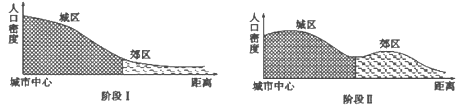
【1】阶段I到阶段II过程中,最不可能出现的是
A. 郊区耕地面积减少
B. 第一产业比重上升
C. 城市人口比重上升
D. 城市规模扩大
【2】阶段II中,城区中心人口密度有所下降的主要原因
①交通通达度提高 ②地租价格上涨 ③环境污染严重 ④远离商业中心
A. ①④ B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4![]() 2KCl+2CrO2Cl2+3COCl2↑。
2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690 pm和780 pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
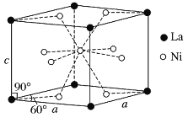
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol1,密度为d g·cm3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×105 g·cm3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com