
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
9.4 g X![]() 6.4 g 固体
6.4 g 固体![]() 蓝色溶液和1.92 g固体
蓝色溶液和1.92 g固体
下列有关说法正确的是( )
A.步骤Ⅰ中减少的3 g固体一定是混合物
B.步骤Ⅱ中质量减少的物质一定是Cu
C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据步骤Ⅱ可以得出,m(Fe2O3)∶m(Cu)=1∶1
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中地理 来源: 题型:
【题目】下图为“世界某地海陆分布示意图”,M地夏季炎热干燥,冬季盛行西南风。读图完成下列各题。
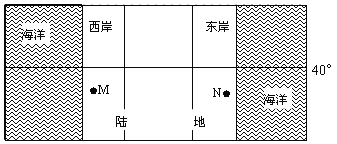
【1】M地的气候类型是( )
A.地中海气候 B.温带海洋性气候
C.热带沙漠气候 D.温带季风气候
【2】根据N地的地理位置推知,N地( )
A.终年高温多雨 B.亚热带常绿硬叶林广布
C.夏季高温多雨 D.终年炎热干燥
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】___production up by 60%,the company has had another excellent year
A.As
B.For
C.With
D.Through
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】下图为“某城市用地功能区规划示意图”。读图回答下列各题。
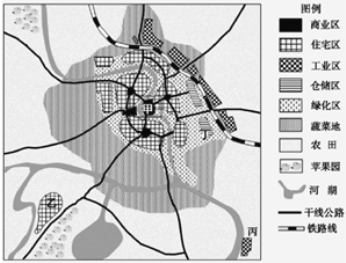
【1】若从环境因素考虑,城市各功能区用地规划合理,该地区最可能
A. 地势起伏小 B. 河流自南向北流
C. 属热带雨林气候 D.盛行东北风
【2】该城市功能区与其形成的主导因素对应正确的是
A.甲一行政因素 B.乙一历史因素
C. 丙一社会因素 D.丁一经济因素
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】—What is your plan for the holiday?
—I’d like___days with my family___climbing
A.to spend;going
B.to spend;to go
C.spendng;going
D.spending;to go
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】读下图,完成下列各题。
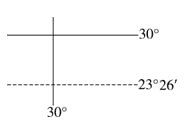
【1】图中纬线横穿该国的北部和南部,经线纵贯该国的中部地区,且北部和东部临海,判断此国家是
A.沙特阿拉伯 B.印度
C.埃及 D.巴西
【2】该国大部分的气候类型为
A.亚热带季风气候 B.热带草原气候
C.热带沙漠气候 D.地中海气候
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+1、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2![]() 2Cu+SO2反应制取粗铜,该反应中 元素被还原。
2Cu+SO2反应制取粗铜,该反应中 元素被还原。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50 ℃,加入H2O2溶液,一段时间后,升温到60 ℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为 。温度控制在50 ℃~60 ℃的原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式: 。
(3)现向Cu、Cu2O和CuO组成的混合物中,加入2 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到4 480 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式为 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.2 mol Cu,将该混合物与稀硫酸充分反应,消耗H2SO4的物质的量为 mol。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】W、R、X、Y、Z是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
W | W的一种单质是自然界硬度最大的晶体 |
X | X基态原子L层中p轨道电子数是s轨道电子数的2倍 |
Y | Y所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
Z | Z位于元素周期表第Ⅷ族,最高能级的原子轨道内只有2个未成对电子 |
回答下列问题:
(1)Z基态原子的价层电子排布式为__________________。第三周期基态原子未成对电子数与Z相同且电负性最大的元素名称为____________。
(2)W在形成化合物时,其键型以共价键为主,原因是 。HYX4的酸性强于HYX3,原因是______。
(3)R和Y可组成原子个数比为1∶3的化合物M,M的立体构型为 ,中心原子的杂化轨道类型为 。
(4)Z(WX)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。根据等电子原理,W、X分子内σ键与π键的个数之比为______________。
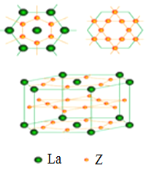
(5)镧和Z形成的合金有很强的储氢能力,其晶胞结构如图。已知该合金为LaZx,晶胞体积为9.0×10-23cm3,储氢后形成LaZxH4.5的合金(氢进入晶胞空隙,体积不变),则LaZx中x=_____(填数值);氢在合金中的密度为_______gcm-3(精确到0.01)。
查看答案和解析>>
科目:高中地理 来源: 题型:
【题目】There were over 1,000 people in need of food,so the government made a(an)___decision that 20,000 bags of rice should be sent to that area
A.urge
B.urgent
C.slow
D.vital
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com