
(15分)实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用)。

可供选择的液体试剂及固体药品:
液体试剂 | 固体药品 |
稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、CaC2、 碱石灰、Cu、Zn、Na2S |
请回答下列问题:
(1)装置B中a仪器的名称 。
(2)可由A装置制取相对分子质量小于32的气体有 (任意写2种)。
(3)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→ →C← ← ←B。写出装置B(无需加热)中反应的离子方程式 。
(4)完成上述实验需选用仪器D和E,D中选用( )、E中选用( )(填写序号)
A.无水氯化钙 B.饱和碳酸氢钠溶液 C.饱和食盐水
D.五氧化二磷 E.碱石灰 F.浓硫酸
(5)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式 。
(6)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子
(1)滴液漏斗(分液漏斗)(2)H2 、NH3、NO
(3)D、E、E,2MnO4-+16H++10Cl-=2Mn2++5C12↑+8H2O (4)E,C、F或F、C
(5)3Cl2+8NH3=6NH4Cl+N2
(6)将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+(或其他合理答案)
【解析】
试题分析:(1)装置B中a仪器的名称是分液漏斗;(2)A装置适宜块状固体与液体反应制取气体;反应不需要加热;制取的气体在液体中的溶解度不大。用A装置制取相对分子质量小于32的气体有H2 、NH3、NO。(3)A制取氨气,然后用盛有碱石灰的干燥管D来干燥氨气;B制取氯气,然后除去杂质HCl气体用盛有饱和食盐水广口瓶E,再用盛有浓硫酸的广口瓶来干燥氯气。最后在C中对气体进行混合。在装置B(无需加热)中制取氯气的反应的离子方程式是2MnO4-+16H++10Cl-=2Mn2++5C12↑+8H2O ; (4)仪器D用于干燥氨气,由于氨气是碱性气体,所以要用碱性干燥剂干燥,用碱石灰,选项是E。装置E首先是除去杂质HCl气体用饱和食盐水,然后干燥气体,由于氯气是酸性气体,所以可以选用酸性干燥剂浓硫酸。因此选项是C、F。(5)根据题意可得方程式:3Cl2+8NH3=6NH4Cl+N2。(6)检验白烟物质是NH4Cl含有的离子是Cl-、NH4+。检验其中的离子的方法是将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+。也可用湿润的红色石蕊试纸,若变为蓝色,就证明含有NH4+。
考点:考查仪器的识别、气体的制备、仪器及试剂的选择、离子的检验、方程式的书写的知识。


科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列说法中错误的是
A.当中心原子的配位数为6时,配合单元常呈八面体空间结构
B.SO3为平面正三角形结构
C.已知[Cu (NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型
D.配位数为4的配合物均为正四面体结构
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片和稀硫酸反应 B.Ba(OH)2?8H2O与NH4Cl反应
C.灼热的炭与CO2反应 D.甲烷在O2中燃烧
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
A.①②④⑤ B.①③④⑤ C.①②③④ D.①②④
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:填空题
(15分)有机物A为芳香烃,质谱分析表明其相对分子质量为92,某课题小组以A为起始原料可以合成酯类香料H和高分子化合物I,其相关反应如下图所示:
已知以下信息:
①碳烯(:CH2)又称卡宾,它十分活跃,很容易用它的两个未成对电子插在烷烃分子的C-H键之间使碳链增长。
②通常在同一个碳原子连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:

(1)A的化学名称为 。
(2)由B生成C的化学方程式为 ,该反应类型为 。 (3)G的结构简式为 。
(4)请写出由F生成I的化学方程式 。
(5)写出G到H的反应方程式 。
(6)H的所有同分异构体中,满足下列条件的共有 种;
①含有苯环 ②苯环上只有一个取代基 ③属于酯类
其中核磁共振氢谱有五种不同化学环境的氢,且峰面积比为1:1:2:2:6的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述不正确的是
A.标准状况下,33.6LCO2中含有氧原子数为3NA
B.1 mol OH-和1 mol -OH(羟基)所含质子数均为9NA
C.常温下,100mL 0.1 mol·L-1醋酸钠溶液中含醋酸根的数目小于0.01NA
D.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2分子数为0.46NA
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:实验题
(本题共10分)
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯)。亚硝酰氯的熔点为-64.5 ℃,沸点为-5.5 ℃,并且遇水蒸气分解为氮的氧化物和氯化氢。
某校化学兴趣小组按如下流程制备亚硝酰氯,实验时,先通入Cl2,待E中U形管内充满黄绿色气体时,再缓缓通入NO。“→”表示气流方向。

34.实验室用氯酸钾和浓盐酸制备Cl2的化学方程式是______________________________。
35.装置F的作用是___________________________________。
36.亚硝酰氯与水反应的化学方程式是________________________________。
37.实验中“先通入Cl2,待E中U形管内充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:选择题
滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是
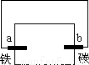

甲 乙
A. a、c B. b、d C. a、d D. b、c
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:实验题
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

37. 步骤③的实验操作名称是_____________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_____________。
38. 步骤④需加入的试剂是________,反应的离子方程式是____________________。
39. 步骤⑤中,某学生选择用苯来提取碘,理由是_______________________________,
_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com