
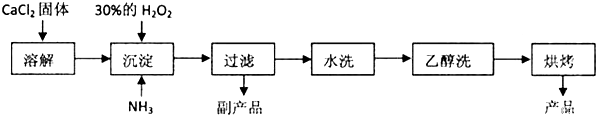
分析 氯化钙固体溶解,再加入过氧化氢、氨气得到反应得到CaO2,氨气中和过氧化氢电离的氢离子,利用CaO2的生成,过滤分离,滤液中含有NH4Cl得到副产品,沉淀经过洗涤、烘干得到过氧化钙.
(1)副产品为氯化铵;搅拌等可以加速溶解;
(2)沉淀会附着氯化铵,用硝酸酸化的硝酸银溶液检验最后一次滤出液中是否含有氯离子;
(3)该反应的反应物为CaCl2、H2O2、NH3,反应生成CaO2•8H2O与NH4Cl;
(4)①碘遇淀粉变蓝色,结束时溶液由蓝色变成无色;
②根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2S2O32-,设样品中CaO2的质量分数为x,根据关系式列方程计算;
③在酸性条件下空气中的O2也可以将KI氧化为I2,使消耗的Na2S2O3增多.
解答 解:氯化钙固体溶解,再加入过氧化氢、氨气得到反应得到CaO2,氨气中和过氧化氢电离的氢离子,利用CaO2的生成,过滤分离,滤液中含有NH4Cl得到副产品,沉淀经过洗涤、烘干得到过氧化钙.
(1)副产品的成分是NH4Cl,CaCl2固体溶解时,为加快溶解速率,可用玻璃棒搅拌,
故答案为:NH4Cl;用玻璃棒搅拌;
(2)沉淀会附着氯化铵,判断沉淀是否洗净的方法是:取最后一次滤出液少许于试管中,滴加HNO3酸化的AgNO3溶液,若产生白色沉淀,说明沉淀未洗净,反之已洗净,
故答案为:取最后一次滤出液少许于试管中,滴加HNO3酸化的AgNO3溶液,若产生白色沉淀,说明沉淀未洗净,反之已洗净;
(3)生成CaO2•8H20的化学方程式为:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O,
故答案为:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O;
(4)①遇淀粉变蓝色,滴入最后一滴Na2S2O3溶液,溶液由蓝色变成无色,且30s内不出现蓝色,说明滴定到达终点,
故答案为:溶液由蓝色变成无色,且30s内不出现蓝色;
②根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2S2O32-,设样品中CaO2的质量分数为x,则:
CaO2~I2~2 S2O32-
72g 2mol
ax g V×10-3L×c mol.L-1
所以72g:ax g=2mol:V×10-3L×c mol.L-1
解得x=$\frac{3.6cV}{a}$%,
故答案为:$\frac{3.6cV}{a}$%;
③在酸性条件下空气中的O2也可以将KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高;在酸性条件下空气中的O2也可以将KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.
点评 本题考查实验方案的设计、物质含量测定、氧化还原反应滴定应用等,题目难度中等,充分考查学生的分析理解能力、知识迁移应用能力,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 正极附近的 SO42-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上有H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷属于饱和链烃,乙烯属于不饱和链烃 | |
| B. | 乙烷分子则为立体结构,不是所有原子都在同一平面上,乙烯分子中所有原子都处于同一平面上 | |
| C. | 乙烷分子存在中的碳碳单键,乙烯分子存在中碳碳双键 | |
| D. | 酸性KMnO4溶液能鉴别乙烷和乙烯,而溴水不能鉴别乙烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
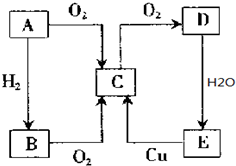 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
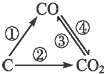 随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).
随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤②③ | B. | ⑥②③① | C. | ⑤⑥③② | D. | ⑥②⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com