
| A.滴加甲基橙后溶液显红色 | B.滴加甲基橙后溶液显黄色 |
| C.溶液中含有OH-离子 | D.溶液中c (OH-)>c(H+) |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题

| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3.0~3.3 | B.3.3~3.5 | C.3.5~4.0 | D.3.7~4.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
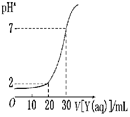
 Cu2++2OH-,Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2++2OH-,Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硝酸为弱电解质 |
| B.该溶液1 mL稀释至100 mL后,pH小于3 |
| C.向该溶液中加入等体积、等浓度的氢氧化钡溶液,混合后溶液pH=7 |
| D.该溶液中水电离出的c(H+)=1×10-13 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a<7时,溶液的pH一定为a |
| B.a>7时,溶液的pH一定为14-a |
| C.a>7时,溶液的pH可能为a也可能为14-a |
| D.a<7时,水的电离受到抑制 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| c(X)/mol·L-1 | 0.035 | 0.070 | 0.03 | 0.06 |
| c(Y)/mol·L-1 | 0.070 | 0.035 | 0.06 | 0.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com