
实验中需用2.0 mol/L的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为
A.950 mL;201.4 g B.1000 mL;212.0 g
C.100 mL;21.2 g D.500 mL;100.7 g
科目:高中化学 来源:2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷(解析版) 题型:选择题
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是
A.白色沉淀是BaSO4和BaSO3
B.溶液的酸性增强
C.白色沉淀是BaSO4
D.FeCl3全部被还原为FeCl2
查看答案和解析>>
科目:高中化学 来源:2016届天津一中高三零月考化学试卷(解析版) 题型:选择题
化学与日常生活密切相关,下列说法正确的是
A.煤经过气化和液化等物理变化可以转化为清洁燃料
B.从海水提取物质都必须通过化学反应才能实现
C.浓硫酸可刻蚀石英制艺术品
D.葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:选择题
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.CO(g)+1/2O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
B.C(s)+1/2O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH=-241.8 kJ·mol-1
D.2C8H18(l)+25O2(g)====16CO2(g)+18 H2O(l) ΔH=-11036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第一次月考化学试卷(解析版) 题型:选择题
二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为: 2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
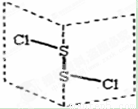
A.S2C12的结构式为Cl—S—S—Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2C12为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省双鸭山市高三上第一次月考化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
编号 | 叙述I | 叙述II |
A | SiO2的熔点很高 | 石英玻璃制作光学透镜 |
B | SO2具有漂白性 | SO2能使高锰酸钾酸性溶液褪色 |
C | N2常压、-196℃条件下易液化 | 液氮应用于冷冻、麻醉 |
D | 硬铝是合金 | 其熔点比金属铝的熔点高 |
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省双鸭山市高三上第一次月考化学试卷(解析版) 题型:选择题
下列有关说法中,不正确的是
A.焰火的五彩缤纷是某些金属元素的性质的展现
B.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一9月检测化学试卷(解析版) 题型:填空题
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还原滴定的反应体系中有反应物和生成物共六种,MnSO4、KMnO4、K2SO4、H2SO3、H2SO4、H2O,其中H2SO3的还原性最强,KMnO4 的氧化性最强。对此反应体系:
(1)被氧化的元素是_______;发生还原反应的过程是________→______。
(2)请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3)反应中H2 SO4 是_______ (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4)当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5)用标准KMnO4 溶液滴定H 2 SO3 时,滴定终点时颜色变化是_______。
(6)滴定过程中.下列图像所表示的关系正确的是_______(填编号)。 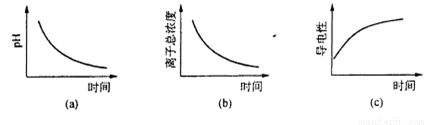
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期一模化学试卷(解析版) 题型:填空题
某溶液仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
阴离子 | Cl- CO32- NO3- SO42- I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是________________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是___________ _____。
(3)甲同学最终确定原溶液中所含阳离子有_______,阴离子有______;并据此推测原溶液应该呈______性,原因是________________(用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com