
�ɶ�����Ԫ����ɵĵ���A��B��C�ͼס��ҡ����������ֻ���������ͼ��ת����ϵ,��֪CΪ�ܶ���С������,��Ϊ�ǵ���ʡ�
��������ת����ϵ�ش���������:
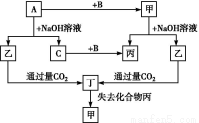
(1)д���������ʵĻ�ѧʽ:A ,B ,�� ��
(2)Ԫ��A�����ڱ��е�λ���� ,д����һ����; ��
(3)д�����б仯�ķ���ʽ:
��A��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
���������CO2��Ӧ�����ӷ���ʽ ��
(1)Si O2 H2SiO3(��H4SiO4)
(2)�������ڢ�A�� �Ʋ��������ά��
(3)��Si+2NaOH+H2O=Na2SiO3+2H2��
��Si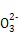 +2CO2+2H2O=H2SiO3��+2HC
+2CO2+2H2O=H2SiO3��+2HC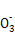 (��Si
(��Si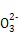 +2CO2+3H2O=H4SiO4��+2HC
+2CO2+3H2O=H4SiO4��+2HC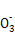 )
)
������������C���ܶ���С������,����C��H2������A+NaOH��Һ C(H2),��AΪAl��Si,����A��Al��Si,������ͨ����CO2��IJ��ﶡʧȥ�Ļ������ӦΪH2O,��BΪO2,�־ݼ�Ϊ�ǵ����,��AӦΪSi,��ΪSiO2,��ΪNa2SiO3,��ΪH2SiO3(��H4SiO4)���ݴ˽���й����⡣
C(H2),��AΪAl��Si,����A��Al��Si,������ͨ����CO2��IJ��ﶡʧȥ�Ļ������ӦΪH2O,��BΪO2,�־ݼ�Ϊ�ǵ����,��AӦΪSi,��ΪSiO2,��ΪNa2SiO3,��ΪH2SiO3(��H4SiO4)���ݴ˽���й����⡣


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ����ר��ͻ�� ר����ѧ��Ӧ��������ϰ���������棩 ���ͣ�ѡ����
���и����Ȼ�ѧ����ʽ�У�Q1��Q2���ǣ� ��
A��CH4(g)��2O2(g)=CO2(g)��2H2O(g)����H����Q1 kJ��mol��1
CH4(g)��3/2O2(g)=CO(g)��2H2O(g)����H����Q2 kJ��mol��1
B��S(g)��O2(g)=SO2(g)����H����Q1 kJ��mol��1
S(s)��O2(g)=SO2(g)����H����Q2 kJ��mol��1
C��H2(g)��Br2(g)=2HBr(g)����H����Q1 kJ��mol��1
H2(g)��Cl2(g)=2HCl(g)����H����Q2 kJ��mol��1
D��HCl(aq)��NaOH(aq)=NaCl(aq)��H2O(l)����H����Q1 kJ��mol��1
CH3COOH(aq)��NaOH(aq)=CH3COONa(aq)��H2O(l)����H����Q2 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��8�绯ѧԭ����ϰ���������棩 ���ͣ�ѡ����
����������,����ȷ���ǣ� ��
A.ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ��
B.�ִ��ײ���Ƕп��,п������,�Է����屻��ʴ
C.������ʴ�ĸ�����Ӧ:Fe-3e-=Fe3+
D.���ʱ,�Ʋ����������,�Ƽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��6��ѧ��Ӧ���ʺͻ�ѧƽ����ϰ���������棩 ���ͣ�ѡ����
������,��������ЧӦ����Դ��ȱ������,����CO2��̼����Ӧ�õ��о��ܵ����ǵ����ӡ�ij�о�С�����÷�Ӧ:CO(g)+H2O(g) H2(g)+CO2(g) ��H=-41.2 kJ/mol�Ʊ�CO2��H2�Ļ������,����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
H2(g)+CO2(g) ��H=-41.2 kJ/mol�Ʊ�CO2��H2�Ļ������,����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
(1)��֪:850 ��ʱ��һ���Ϊ10 L�ĺ����ܱ�������,ͨ��һ������CO��H2O,CO��H2OŨ�ȱ仯��ͼ��ʾ:
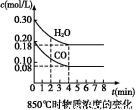
����˵����ȷ���� (�����)��
A.�ﵽƽ��ʱ,���������ʵ�����0.12 mol
B.�ﵽƽ��ʱ,��Ӧ��ϵ���ջ�ų�49.44 kJ����
C.��4 minʱ,��������ƽ����Է����������ٱ仯
D.��6 minʱ,�������¶�,��Ӧƽ�ⳣ�����С
E.��8 minʱ,�����뺤��,�ᵼ��v(CO)����v(H2O)��
(2)850 ��ʱ,�����ݻ�Ϊ2 L���ܱ�������ͬʱ����1.0 mol CO��3.0 mol H2O��1.0 mol CO2��x mol H2����Ҫʹ������Ӧ��ʼʱ������Ӧ�������,��xӦ����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��6��ѧ��Ӧ���ʺͻ�ѧƽ����ϰ���������棩 ���ͣ�ѡ����
����ͬ�¶���,��H2��N2�������尴��ͬ����ͨ����ͬ�ĺ����ܱ�������,������Ӧ:3H2+N2 2NH3��
2NH3��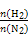 ��ʾ��ʼʱH2��N2�����ʵ���֮��,����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ���ǣ� ��
��ʾ��ʼʱH2��N2�����ʵ���֮��,����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ���ǣ� ��
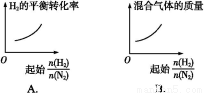
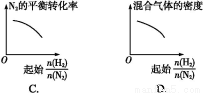
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��5���ʽṹ Ԫ����������ϰ���������棩 ���ͣ�ѡ����
����˵����,��ȷ���ǣ� ��
A.��A��Ԫ�صĽ����ԱȢ�A��Ԫ�صĽ�����ǿ
B.��A��Ԫ�ص��⻯����,���ȶ����⻯�ﳣ��ʱΪ��ɫҺ��
C.ij����Ԫ��X����̬�⻯�ﻯѧʽΪHX,�����������Ϊ+7��
D.����Ԫ�ص�ԭ��ֻ�л�ԭ��,����������ֻ��������
�鿴�𰸺ͽ���>>
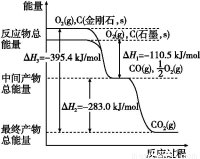
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��4��ѧ��Ӧ�е������仯��ϰ���������棩 ���ͣ������
��1����ͼ��ʾ���ʯ��ʯī����ط�Ӧ�����е������仯��ϵ��
д��ʯīת��Ϊ���ʯ���Ȼ�ѧ����ʽ ��
(2)��֪:Ti(s)+2Cl2(g) TiCl4(l)��H=-804.2 kJ/mol
TiCl4(l)��H=-804.2 kJ/mol
2Na(s)+Cl2(g)=2NaCl(s) ��H=-882.0 kJ/mol
Na(s)=Na(l) ��H=+2.6 kJ/mol
��TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)�Ħ�H= kJ/mol��
(3)��֪:
��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)��H=-a kJ/mol
��CH3OH(l)+O2(g)=CO(g)+2H2O(l)��H=-b kJ/mol
��H2O(g)=H2O(l) ��H=-c kJ/mol��:2CO(g)+O2(g) 2CO2(g)�Ħ�H= kJ/mol��
2CO2(g)�Ħ�H= kJ/mol��
(4)��ҵ���ڴ��������¿�����CO�ϳɼ״�:CO(g)+2H2(g)=CH3OH(g),��ͼ��ʾ��Ӧ�����������ı仯�����
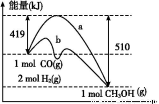
��ͼ��,���� (�a����b��)��ʾʹ���˴���;�÷�Ӧ���� (����ȡ����ȡ�)��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��3������ԭ��Ӧ ���ӷ�Ӧ��ϰ���������棩 ���ͣ�ѡ����
�ڲ�ͬ�¶���,ˮ��Һ��c��H+����c��OH-������ͼ��ʾ��ϵ�����й������ӹ���˵������ȷ���ǣ� ��
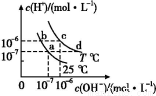
A.a���Ӧ����Һ�д�������:Fe3+��Na+��Cl-��S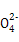
B.b���Ӧ����Һ�д�������:N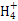 ��Ba2+��OH-��I-
��Ba2+��OH-��I-
C.c���Ӧ����Һ�д�������:Na+��Ba2+��Cl-��HC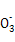
D.d���Ӧ����Һ�д�������:Na+��K+��S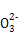 ��Cl-
��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��13���ʽṹ������ѡ��3��ϰ���������棩 ���ͣ������
���������仯�����ںϽ�����Լ������ȷ���Ӧ�ù㷺��
(1)��̬Niԭ�ӵļ۵���(��Χ����)�Ų�ʽΪ ;
(2)����������CO�γ������Ni(CO)4,д����CO��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ �� ;
(3)�ܶ�����л�����Ni���¿���H2�����ӳɷ�Ӧ��
���CH2=CH2����HC��CH����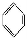 ����HCHO,����̼ԭ�Ӳ�ȡsp2�ӻ��ķ����� (���������),HCHO���ӵ�����ṹΪ ��;
����HCHO,����̼ԭ�Ӳ�ȡsp2�ӻ��ķ����� (���������),HCHO���ӵ�����ṹΪ ��;
(4)Ni2+��Fe2+�İ뾶�ֱ�Ϊ69 pm��78 pm,���۵�NiO FeO(���������);
(5)����������(La)�γɵĺϽ���һ�����õĴ������,�侧���ṹʾ��ͼ����ͼ��ʾ���úϽ�Ļ�ѧʽΪ ;
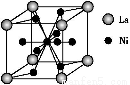
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com