
| A���Ȼ�ѧ����ʽ�л�ѧ��������ʾ���Ӹ��� |
| B���÷�Ӧ�Ħ�H2����483.6 kJ/mol |
| C��|��H2|<|��H1| |
| D��|��H2|>|��H1| |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ��
�� CH3OH(g)��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���ʾ��
CH3OH(g)��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���ʾ��| T/�� | T1 | T2 | T3 |
| K | 1/1000 | 1/40 | 25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��̼��Ʒֽ� | B�����������������Ȼ�茶��巴Ӧ |
| C��̼�������̼��Ӧ | D������ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
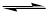 2NH3 ( g ) ��H =" -92.0" kJ/mol�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ�� ��
2NH3 ( g ) ��H =" -92.0" kJ/mol�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ�� �� | A��һ������92.0 kJ | B��һ������92.0 kJ | C��һ��С��92.0 kJ | D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

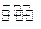 ClO��g��+3H2��g����H>0��
ClO��g��+3H2��g����H>0��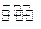 CH3OH��g����H=��90.1kJ��mol-1�����������´�ƽ�⣬���д�ʩ����ʹn(CH3OH)/n(CO)�������________��ѡ����ţ���
CH3OH��g����H=��90.1kJ��mol-1�����������´�ƽ�⣬���д�ʩ����ʹn(CH3OH)/n(CO)�������________��ѡ����ţ���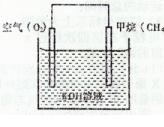
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1mol�����ǡ���к�ʱ���ų����������к��� |
| B����ѧ��Ӧ�е������仯����Ҫ���ɻ�ѧ���ı仯����� |
| C����Ҫ���Ȳ��ܷ����ķ�Ӧ��һ�������ȷ�Ӧ |
| D����Ӧ��������������������������ķ�Ӧ������Ҫ���ȾͿ����з�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��Zn��H2SO4������������ ZnSO4��H2�������� |
| B����Ӧ������������ϵ������ͼ��ʾ |
| C�������÷�Ӧ��Ƴ�ԭ��أ���ZnΪ���� |
| D�������÷�Ӧ��Ƴ�ԭ��أ�����65gп�ܽ�ʱ�������ų�11.2L���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2H2(g) + O2(g) ="=" 2H2O(1) ��H�� �D285.8kJ��mol |
| B��2H2(g) + O2(g) ="=" 2H2O(1) ��H�� +571.6 kJ��mol |
| C��2H2(g) + O2(g) ="=" 2H2O(g) ��H�� �D571.6 kJ��mol |
| D��H2(g) + O2(g) ="=" H2O(1) ��H�� �D285.8kJ��mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com